网址:http://m.1010jiajiao.com/timu3_id_162039[举报]
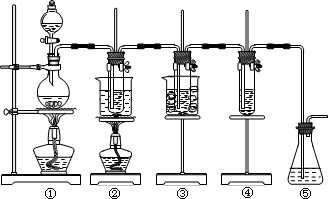
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.图中:
①为氯气发生装置;
②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;
③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式________;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置.
A.碱石灰
B.氢氧化钠溶液
C.饱和食盐水
D.浓硫酸
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol.其主要原因有:
①________,
②________.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①________;
②________.
反应完毕经冷却后,②的试管中有大量晶体析出.下图中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________(填写实验操作名称).

(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.


(1)含酚酞的0.01mol?L-1 CH3COONa溶液显浅红色的原因为:
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01mol?L-1 CH3COONa溶液中加入少量浓盐酸,则CH3COO-水解平衡移动的方向为_
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO- )-c(Na+)=
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图2,则HX的酸性
已知氯气和氢氧化钠的反应条件不同,产物也不同,在实验室里可用如图所示装置制取氯酸钠次氯酸钠和探究氯水的性质.

图中:
①为氯气发生装置;
②的试管里盛有15 mL 30% NaOH溶液,并置于热水浴中;
③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置.
(A)碱石灰
(B)饱和食盐水
(C)浓硫酸
(D)饱和碳酸氢钠溶液
(2)比较制取氯酸钠和次氯酸钠的条件,指出二者的差异:________.
(3)本实验中制取次氯酸钠的离子方程式是________.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

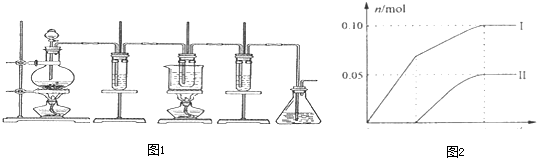
如图所示,是制取氯气并探究氯气的性质的实验装置.图1中:①氯气发生装置;②溴化亚铁溶液;③15mL 30% KOH溶液,并置于水浴中;④石灰乳;⑤尾气吸收装置.已知:氯气和碱的反应为放热反应.温度较高时,氯气和碱还能发生如下反应:
3Cl2+6OH-
| ||
(1)实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)通入足量氯气后,②中反应的化学方程式为
(3)利用③反应后的溶液可制备KClO3晶体,实验过程:溶液→蒸发浓缩→冷却结晶→过滤→洗涤→干燥→氯酸钾晶体.蒸发浓缩时,当
(4)④的产物中Ca(ClO)2的质量明显小于理论值.为探究产物的组成,另取一定量的石灰乳,缓慢、匀速地通入足量氯气,ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线如图2所示(不考虑氯气和水的反应).则图2中曲线I表示