网址:http://m.1010jiajiao.com/timu3_id_161292[举报]
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。


在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:
![]()
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。


某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
查看习题详情和答案>>下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。


在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:

奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。


某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
(1)一定温度下,氧化铁可以与一氧化碳发生如下反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=QkJ?mol-1
①该反应的平衡常数表达式K=
②该温度时,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,5min后,生成了单质铁11.2g,则这段时间内CO的反应速率为
③达平衡后,若温度升高
| [CO] | [CO2] |
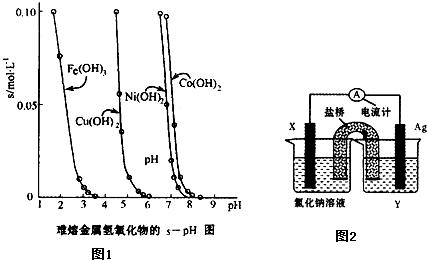
(2)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的.如图1是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol?L-1).若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为
A.小于1 B.4左右 C.大于6 D.大于9
(3)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=
(4)依据氧化还原反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s)设计成如图2所示的原电池,则关于该电池装置的说法中不正确的是
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-.
(14分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。则上述转化的重要意义在于 。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;lg1.1×10-36=-35.96)
查看习题详情和答案>>