摘要:能与Cu2+反应.且发生的是氧化还原反应的是( ) A.OH- B.Ag C.H+ D.Al
网址:http://m.1010jiajiao.com/timu3_id_161066[举报]
某化学研究小组同学认为NH3中N元素处于最低价,得出NH3应具有还原性的结论,并设计了如下实验装置进行研究(夹持装置未画出)
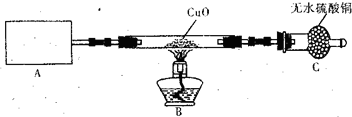
请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式______.
(2)该实验中的A部分的装置是下图中的______(填写装置的序号).

(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明'Cu0能被NH3还原,该反摩的化学方程式是______.
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施______.
(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O.
查看习题详情和答案>>

请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式______.
(2)该实验中的A部分的装置是下图中的______(填写装置的序号).

(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明'Cu0能被NH3还原,该反摩的化学方程式是______.
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施______.
(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O.
(2011?宝鸡一模)某化学研究小组同学认为NH3中N元素处于最低价,得出NH3应具有还原性的结论,并设计了如下实验装置进行研究(夹持装置未画出)

请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式
(2)该实验中的A部分的装置是下图中的
(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明'Cu0能被NH3还原,该反摩的化学方程式是
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施
(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O.
查看习题详情和答案>>

请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式
2NH4Cl+Ca(OH)4
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)4
CaCl2+2NH3↑+2H2O
.
| ||
(2)该实验中的A部分的装置是下图中的
f
f
(填写装置的序号).
(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明'Cu0能被NH3还原,该反摩的化学方程式是
3CuO+2NH3
3Cu+N2+3H2O
| ||
3CuO+2NH3
3Cu+N2+3H2O
.
| ||
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施
在A和B之间增加一个装有碱石灰的干燥管,在C装置后再接一个装有浓硫酸的洗气瓶来吸收多余的氨气并防止外界水蒸气进入影响实验
在A和B之间增加一个装有碱石灰的干燥管,在C装置后再接一个装有浓硫酸的洗气瓶来吸收多余的氨气并防止外界水蒸气进入影响实验
.(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O.
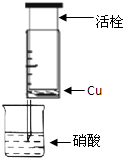 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.(1)甲组同学设计如图装置来证实稀硝酸与铜反应,步骤如下.
A、检验50ml针筒的气密性.
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后
针头朝上倒放
针头朝上倒放
.C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①B中应补充的操作是
推活栓,使针头内充满水
推活栓,使针头内充满水
.②一段时间后在针筒内观察到溶液颜色为蓝色,有
无色
无色
色气体产生.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是
往针筒内抽气,气体由无色变红棕色
往针筒内抽气,气体由无色变红棕色
.(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)
不同意
不同意
,原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同
相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同
.(结合表格信息加以阐述)②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因
过量的硝酸分解会产生红棕色的NO2
过量的硝酸分解会产生红棕色的NO2
.方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理
4NO2+O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3
.方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个
方案二
方案二
. 为了开发新的功能材料,研究人员将碳纳米管a进行下列化学反应,在强氧化条件下,碳纳米管上的环被打开生成新的基团,得到改性碳纳米管.
为了开发新的功能材料,研究人员将碳纳米管a进行下列化学反应,在强氧化条件下,碳纳米管上的环被打开生成新的基团,得到改性碳纳米管.(1)反应①的类型是
氧化还原反应或氧化反应
氧化还原反应或氧化反应
,反应②的有机反应类型是取代反应
取代反应
,物质b中含氧官能团的名称是羧基
羧基
.(2)研究人员对a、b、d三种物质的热稳定性进行了研究.分别取三种物质的样品隔绝空气加热,得到固体的质量分数(残留固体与样品的质量比值)随温度变化的曲线见图:

①b物质在加热过程中质量发生变化的原因是
羧基脱去
羧基脱去
;②在200℃~400℃之间d物质比b物质固体质量下降快的原因是
d物质脱去的基团的质量比b物质脱去的基团的质量大很多,且易脱去
d物质脱去的基团的质量比b物质脱去的基团的质量大很多,且易脱去
.(3)通过大量实验发现,d物质对水中重金属离子(Cu2+、Pb2+等)有富集作用.写出改性碳纳米管d物质的一种用途:
处理含Cu2+、Pb2+等离子的污水
处理含Cu2+、Pb2+等离子的污水
.中国青铜文化源远流长,铜及其化合物在现代生产生活中仍然有极其重要的作用。
(1)考古发掘中经常出土青铜器,青铜器出土后,防止青铜器继续锈蚀的关键是_________。
(2)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂。在实验室里可模拟工业过程制取氧化亚铜,总反应的方程式是:2Cu+H2O Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。
Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。
(1)考古发掘中经常出土青铜器,青铜器出土后,防止青铜器继续锈蚀的关键是_________。
(2)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂。在实验室里可模拟工业过程制取氧化亚铜,总反应的方程式是:2Cu+H2O
 Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。
Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。 
A.图中虚线框内需连接直流电源,且正极与石墨相连
B.氧化铜高温分解也可能得到氧化亚铜
C.在上述装置中,阳极的电极反应式是2Cu-2e-+2OH-=Cu2O+H2O
(3)硫酸铜是一种应用极其广泛的化工原料,现用废铜(主要杂质为Fe)作原料来制备胆矾,有人设计了如下流程
B.氧化铜高温分解也可能得到氧化亚铜
C.在上述装置中,阳极的电极反应式是2Cu-2e-+2OH-=Cu2O+H2O
(3)硫酸铜是一种应用极其广泛的化工原料,现用废铜(主要杂质为Fe)作原料来制备胆矾,有人设计了如下流程

pH的控制可参考下列数据

请根据上述流程回答下列问题:
①A物质最好选用______(填字母)。
a.稀H2SO4和O2 b.浓H2SO4 c.浓FeCl3溶液 d.酸性KMnO4溶液
②I中加H2O2的目的是_________________(用离子方程式表示)。Ⅱ中加Cu2(OH)2CO3的目的是_____________。
③Ⅲ中加热煮沸时发生反应的离子方程式为________________。
④V中加H2SO4调节pH=1是为了____________。
查看习题详情和答案>>
①A物质最好选用______(填字母)。
a.稀H2SO4和O2 b.浓H2SO4 c.浓FeCl3溶液 d.酸性KMnO4溶液
②I中加H2O2的目的是_________________(用离子方程式表示)。Ⅱ中加Cu2(OH)2CO3的目的是_____________。
③Ⅲ中加热煮沸时发生反应的离子方程式为________________。
④V中加H2SO4调节pH=1是为了____________。