摘要:7.工业上由NaOH 溶液制固体烧碱.需在下列哪种容器中进行 ( ) A.陶瓷 B.玻璃 C.铁 D.铂
网址:http://m.1010jiajiao.com/timu3_id_160640[举报]
无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去).已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂.
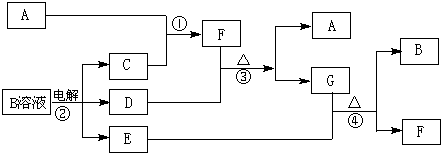
(1)写出化学式F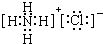
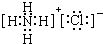 ;
;
(2)鉴定G中阳离子的实验方法和现象
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目
 .
.
查看习题详情和答案>>

(1)写出化学式F
NH3
NH3
,写出电子式G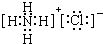
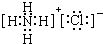
(2)鉴定G中阳离子的实验方法和现象
取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色
取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色
;(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式
2OH-+Cl2=ClO-+Cl-+H2O
2OH-+Cl2=ClO-+Cl-+H2O
、8NH3+3Cl2
N2+6NH4Cl
| ||
8NH3+3Cl2
N2+6NH4Cl
.
| ||
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目


完成下列反应的离子方程式
①工业上用NaOH溶液吸收制硝酸的尾气
②过量的硫化氢通入氢氧化钠溶液中
③实验室用三氯化铁溶液制备氢氧化铁胶体
④用惰性电极电解MgCl2溶液
⑤过量的铁投入稀硝酸中
⑥硫化氢使湿润的醋酸铅试纸变黑
⑦NH4HCO3与NaOH溶液共热
查看习题详情和答案>>下列关于化工生产原理的叙述中,符合实际的是( )
| A、工业上用NaOH溶液来去除MgCl2酸性溶液中的FeCl3 | B、氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 | C、采用高压条件,增大合成氨反应的化学平衡常数,增大原料转化率 | D、用Na2CO3溶液浸泡水垢,实现CaSO4向CaCO3的转化 |
工业上由废铜屑制硫酸铜晶体的流程如下:

(1)下列溶解铜屑的两种方案中,方案二的优点是 .(答两点即可)
方案一:向铜屑中加入足量的浓硫酸并加热.
方案二:向铜屑中加入少量的银粉再加足量的稀硫酸并通入足量空气.
(2)测定硫酸铜晶体(CuSO4?xH2O)中结晶水数目可通过以下实验步骤确定:
Ⅰ.称取0.4820g样品置于小烧杯中,加入适量稀硫酸,加热溶解,边搅拌边滴加BaCl2到沉淀完全;
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为0.4660g.
回答下列问题:
①计算CuSO4?xH2O中的x= (要求写出计算过程).
②步骤Ⅲ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,若其他操作均正确,则x的测定结果将 (填“偏低”、“偏高”或“不变”).
查看习题详情和答案>>

(1)下列溶解铜屑的两种方案中,方案二的优点是
方案一:向铜屑中加入足量的浓硫酸并加热.
方案二:向铜屑中加入少量的银粉再加足量的稀硫酸并通入足量空气.
(2)测定硫酸铜晶体(CuSO4?xH2O)中结晶水数目可通过以下实验步骤确定:
Ⅰ.称取0.4820g样品置于小烧杯中,加入适量稀硫酸,加热溶解,边搅拌边滴加BaCl2到沉淀完全;
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为0.4660g.
回答下列问题:
①计算CuSO4?xH2O中的x=
②步骤Ⅲ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,若其他操作均正确,则x的测定结果将
[化学--选修2:化学与技术]
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.
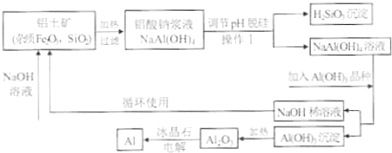
回答下列问题:
(1)操作I的名称是 ;得到的H2SiO3沉淀经过处理可得到硅胶,写出硅胶的一种用途 .
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是 .铝电解槽的阳极材料为碳块,需要定期更换,说明原因 .
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的 性.
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式 .
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式 .
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
Al2O3?H2O+2H2O↑ Al2O3?H2O
Al2O3+H2O↑
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是 .
查看习题详情和答案>>
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.

回答下列问题:
(1)操作I的名称是
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
| ||
| ||
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是