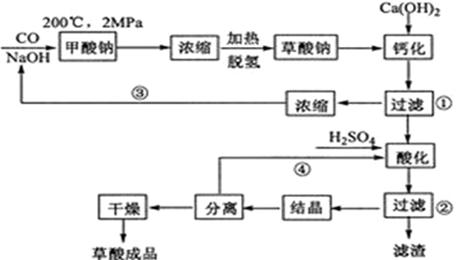
题目内容
[化学--选修2:化学与技术]
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.
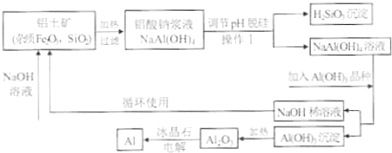
回答下列问题:
(1)操作I的名称是 ;得到的H2SiO3沉淀经过处理可得到硅胶,写出硅胶的一种用途 .
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是 .铝电解槽的阳极材料为碳块,需要定期更换,说明原因 .
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的 性.
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式 .
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式 .
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
Al2O3?H2O+2H2O↑ Al2O3?H2O
Al2O3+H2O↑
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是 .
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.

回答下列问题:
(1)操作I的名称是
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
| ||
| ||
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是
分析:(1)分离难溶性固体和溶液的方法是过滤;硅胶能作干燥剂;
(2)氧化铝熔点较高,加入冰晶石能降低氧化铝熔融的温度;碳被氧化生成二氧化碳;
(3)氧化铝能溶于强酸或强碱;
(4)铝土矿中二氧化硅能和氢氧化钠溶液反应生成硅酸钠和水;
(5)Al(OH)4-分解生成氢氧化铝和氢氧根离子;
(6)根据Al2O3?H2O中氢元素的质量分数和实际固体中氢元素质量分数确定固体成分.
(2)氧化铝熔点较高,加入冰晶石能降低氧化铝熔融的温度;碳被氧化生成二氧化碳;
(3)氧化铝能溶于强酸或强碱;
(4)铝土矿中二氧化硅能和氢氧化钠溶液反应生成硅酸钠和水;
(5)Al(OH)4-分解生成氢氧化铝和氢氧根离子;
(6)根据Al2O3?H2O中氢元素的质量分数和实际固体中氢元素质量分数确定固体成分.
解答:解:(1)分离硅酸沉淀和可溶性的盐应该采用过滤的方法,硅胶具有吸水性,能作干燥剂,
故答案为:过滤;干燥剂;
(2)氧化铝熔点较高,如果通过单纯电解氧化铝而冶炼铝,由于温度高导致对设备要求高且浪费资源,加热冰晶石后能降低氧化铝熔融温度,从而减少资源浪费,所以加入冰晶石的作用是助溶剂或降低氧化铝的熔点;
电解时,阳极上生成氧气,高温条件下,碳和氧气反应生成二氧化碳而消耗阳极材料,所以要不断补充阳极材料,故答案为:助溶剂或降低氧化铝的熔点;阳极产生的氧气与阳极材料碳反应生成二氧化碳,消耗了阳极材料;
(3)氧化铝能和稀盐酸反应生成氯化铝和水,和氢氧化钠溶液反应生成偏铝酸钠和水,所以氧化铝具有两性,用氢氧化钠溶液溶解氧化铝是利用了氧化铝的两性,故答案为:两;
(4)二氧化硅属于酸性氧化物,能和氢氧化钠溶液反应生成硅酸钠和水,离子反应方程式为:SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(5)Al(OH)4-分解生成氢氧化铝和氢氧根离子,离子反应方程式为:Al(OH)4-=Al(OH)3↓+OH-,
故答案为:Al(OH)4-=Al(OH)3↓+OH-;
(6)Al2O3?H2O中氢元素的质量分数=
×100%=1.67%,加热后固体中氢元素的质量分数是1.0%,说明固体中含有Al2O3和Al2O3?H2O,故答案为:Al2O3和Al2O3?H2O.
故答案为:过滤;干燥剂;
(2)氧化铝熔点较高,如果通过单纯电解氧化铝而冶炼铝,由于温度高导致对设备要求高且浪费资源,加热冰晶石后能降低氧化铝熔融温度,从而减少资源浪费,所以加入冰晶石的作用是助溶剂或降低氧化铝的熔点;
电解时,阳极上生成氧气,高温条件下,碳和氧气反应生成二氧化碳而消耗阳极材料,所以要不断补充阳极材料,故答案为:助溶剂或降低氧化铝的熔点;阳极产生的氧气与阳极材料碳反应生成二氧化碳,消耗了阳极材料;
(3)氧化铝能和稀盐酸反应生成氯化铝和水,和氢氧化钠溶液反应生成偏铝酸钠和水,所以氧化铝具有两性,用氢氧化钠溶液溶解氧化铝是利用了氧化铝的两性,故答案为:两;
(4)二氧化硅属于酸性氧化物,能和氢氧化钠溶液反应生成硅酸钠和水,离子反应方程式为:SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(5)Al(OH)4-分解生成氢氧化铝和氢氧根离子,离子反应方程式为:Al(OH)4-=Al(OH)3↓+OH-,
故答案为:Al(OH)4-=Al(OH)3↓+OH-;
(6)Al2O3?H2O中氢元素的质量分数=
| 1×2 |
| 27×2+16×3+18 |
点评:本题以铝及其化合物为载体考查了化学与技术,明确铝及其化合物的性质是解本题关键,再结合铝的活动性确定金属的冶炼方法,注意冶炼铝不能用冶炼氯化铝的方法冶炼,氯化铝为分子晶体,熔融状态不导电,为易错点.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目

 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]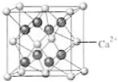 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是