摘要:N=n·NA 满足上述关系的粒子是构成物质的基本粒子(如分子.原子.离子.质子.中子.电子数)或它们的特定组合. 如:1molCaCl2与阿伏加德罗常数相等的粒子是CaCl2粒子.其中Ca2+为1mol.Cl-为2mol.阴阳离子之和为3mol或原子数为3mol. 在使用摩尔表示物质的量时.应该用化学式指明粒子的种类.而不使用该粒子的中文名称.例如说“1mol氧 .是指1mol氧原子.还是指1mol氧分子.含义就不明确.又如说“1mol碳原子 .是指1mol12C.还是指1mol13C,含义也不明确. 粒子集体中可以是原子.分子.也可以是离子.电子等.例如:1molF,0.5molCO2.1000molCO32-.amole-.1.5molNa2CO3·10H2O等. 1molF中约含6.02×1023个F原子,0.5molCO2中约含0.5×6.02×1023个CO2分子, 1kmolCO32-中约含1000×6.02×1023个CO32-离子, amole-中约含a×6.02×1023个e-,
网址:http://m.1010jiajiao.com/timu3_id_160150[举报]
 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.第①步:将硼镁矿用浓碱NaOH溶液溶解,过滤得NaBO2溶液.
第②步:将NaBO2浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7?10H2O.
第③步:将硼砂溶于水后,用H2SO4调节酸度,过滤得H3BO3晶体.
第④步:加热硼酸使之脱水生成氧化物.
第⑤步:脱水产物用镁还原即得粗单质硼.请回答下列问题:
(1)第①步和第⑤步的化学方程式分别为
(2)将制得的粗硼在一定条件下反应全部生成BI3,然后BI3热分解可以得到纯净的单质硼.0.20g粗硼制成的BI3分解得到的I2全部被收集后,用 2.00mol/LNa2S2O3溶液滴定,用去27.00mL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-).
①Na2S2O3溶液成碱性,用离子方程式表达其原因
②粗硼中硼的含量为
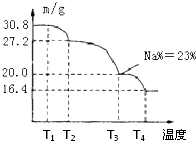
(3)上述制得的硼砂晶体(Na2B4O7?10H2O)还可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.已知纯品过硼酸钠晶体中各元素的物质的量之比为n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如下图所示,则T3时所得晶体的化学式为:
(2009?兖州市模拟)下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.

(1)写出g元素在周期表中的位置:
(2)下列
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(3)现有下列短周期元素性质的数据:
试回答下列问题:
I.上述元素中①、②、⑥分别为
II.元素④与元素⑦相比较,气态氢化物较稳定的是
III.工业上获取⑤单质的主要化学反应方程式为:
IV.⑤和⑥形成的化合物中化学键是
V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明).
查看习题详情和答案>>

(1)写出g元素在周期表中的位置:
第四周期,第ⅣA族
第四周期,第ⅣA族
.(2)下列
①④
①④
(填写编号)组元素的单质可能都是电的良导体.①a、c、h ②b、g、k ③c、h、l ④d、e、f
(3)现有下列短周期元素性质的数据:
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高增化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
I.上述元素中①、②、⑥分别为
O、Mg、Na
O、Mg、Na
,上述元素中处于第二周期的有Li、N、O
Li、N、O
(以上均用元素符号表示).II.元素④与元素⑦相比较,气态氢化物较稳定的是
NH3
NH3
(填化学式).III.工业上获取⑤单质的主要化学反应方程式为:
2NaCl+2H2O
2NaCl+Cl2↑+H2↑
| ||
2NaCl+2H2O
2NaCl+Cl2↑+H2↑
.
| ||
IV.⑤和⑥形成的化合物中化学键是
离子键
离子键
.V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明).
PET是世界上产量最大的合成纤维,其结构简式为: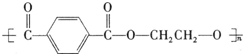 .有人以石油产品对二甲苯和最简单的烯经D为原料,设计合成PET的工业生产流程如下(反应中部分无机反应物及产物未表示):
.有人以石油产品对二甲苯和最简单的烯经D为原料,设计合成PET的工业生产流程如下(反应中部分无机反应物及产物未表示):
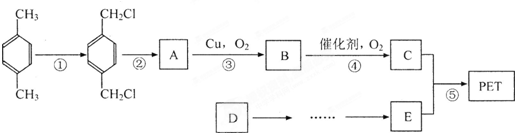
请回答下列问题:
(1)发生反应①需加入的反应物及其条件是 、 ;
发生反应②的反应物及反应条件是 、 .
(2)过程⑤的反应类型是 .
(3)写出反应③的化学方程式 .
(4)有机物A有多种同分异构体,写出满足下列条件的A的一种同分异构体X的结构简式: .
①在X中滴入FeCl3溶液呈紫色,②X分子结构中只有一个甲基,③1molX分别与足量的金属钠、NaOH溶液反应,消耗n(Na):n(NaOH)=2:1.
(5)从D到E,工业上一般通过二步反应来完成.有人从原子利用率100%的角度提出通过D与某种无机物质一步合成E,该无机物是 .
查看习题详情和答案>>
 .有人以石油产品对二甲苯和最简单的烯经D为原料,设计合成PET的工业生产流程如下(反应中部分无机反应物及产物未表示):
.有人以石油产品对二甲苯和最简单的烯经D为原料,设计合成PET的工业生产流程如下(反应中部分无机反应物及产物未表示):
请回答下列问题:
(1)发生反应①需加入的反应物及其条件是
发生反应②的反应物及反应条件是
(2)过程⑤的反应类型是
(3)写出反应③的化学方程式
(4)有机物A有多种同分异构体,写出满足下列条件的A的一种同分异构体X的结构简式:
①在X中滴入FeCl3溶液呈紫色,②X分子结构中只有一个甲基,③1molX分别与足量的金属钠、NaOH溶液反应,消耗n(Na):n(NaOH)=2:1.
(5)从D到E,工业上一般通过二步反应来完成.有人从原子利用率100%的角度提出通过D与某种无机物质一步合成E,该无机物是
 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)═2NO(g)△H=+180.6kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
则反应 C(s)+2NO(g)═CO2(g)+N2(g)△H=
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为
NO2+G
| 催化剂 |
下列化合物中,满足上述反应式中的G是
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则反应的离子方程式为:
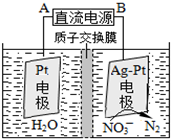
②在酸性条件下,电化学降解NO3-的原理如图,电源正极为:
 已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:(1)F元素价层电子排布式为
3d64s2
3d64s2
.(2)关于B2A2的下列说法中正确的是
CD
CD
.A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s-spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是
直线型
直线型
.(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因
N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定
N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定
.(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有
极性键、非极性键
极性键、非极性键
键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,则M的电子式为



(6)E的氢化物的价层电子对互斥理论模型为
四面体型
四面体型
,E 原 子的杂化方式为SP3
SP3
杂化.(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为
2b3:a3
2b3:a3
,F原子配位数之比为3:2
3:2
.