摘要:(1)Cu2+减少.Fe2+增多 Fe+Cu2+==Fe2++Cu (2)Fe+Cu2+ == Fe2+ + Cu 56 64 △m=8 m(Fe) △m'=0.8g 所以m 答:略
网址:http://m.1010jiajiao.com/timu3_id_160080[举报]
(10分)一化学研究性学习小组对某工厂利用FeCl3溶液与铜反应制印刷电路板所得废液进行探究。
(1)甲同学取10mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥、称重为8.61g,乙同学另取10mL废液,加入某试剂,将pH调至4.0,产生沉淀,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32g。
已知有关金属离子从开始沉淀到沉淀完全时溶液的pH为:
 Fe3+:2.7~3.7 Cu2+:5.2~6.4 Fe2+:7.6~9.6
Fe3+:2.7~3.7 Cu2+:5.2~6.4 Fe2+:7.6~9.6
试求:
(1)上述废液中c(Fe3+)、 c(Cu2+)、 c(Fe2+)
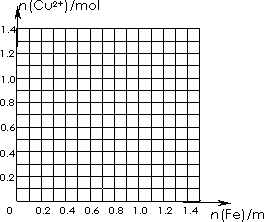
(2)两同学为了从废液中回收铜,取上述1L废液加入铁粉,充分反应。请画出加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用该曲线计算,当铜离子的物质的量减少一半时,加入铁粉的质量为多少克? 查看习题详情和答案>>一化学研究性学习小组对某工厂利用FeCl3溶液与铜反应制印刷电路板所得废液进行探究.
(1)甲同学取10 mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥、称重为8.61 g,乙同学另取10 mL废液,加入某试剂,将pH调至4.0,产生沉淀,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32 g.
已知有关金属离子从开始沉淀到沉淀完全时溶液的pH为:
Fe3+:2.7~3.7 Cu2+:5.2~6.4 Fe2+:7.6~9.6
试求:
(1)上述废液中c(Fe3+)、c(Cu2+)、c(Fe2+)
(2)两同学为了从废液中回收铜,取上述1 L废液加入铁粉,充分反应.请画出加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用该曲线计算,当铜离子的物质的量减少一半时,加入铁粉的质量为多少克?
除去下列物质的杂质(括号内物质为杂质),写出所加试剂的化学式及有关反应的离子方程式.
(1)FeCl2(CuCl2)试剂
(2)NaCl(Na2SO4)试剂
查看习题详情和答案>>
(1)FeCl2(CuCl2)试剂
Fe
Fe
离子方程式Cu2++Fe=Cu+Fe2+
Cu2++Fe=Cu+Fe2+
(2)NaCl(Na2SO4)试剂
BaCl2
BaCl2
离子方程式Ba2++SO42-=BaSO4↓
Ba2++SO42-=BaSO4↓
.粗铜中常含有金、银、铁、锌等杂质,需经过电解精炼.在工业精炼铜的过程中,电解液中C(Cu2+)逐渐下降,C(Fe2+)、C(Zn2+)会逐渐增加.
Ⅰ、写出精炼粗铜过程中阳极上发生的电极反应
Ⅱ、精炼过程中需定时除去其中的Fe2+、Zn2+.下表为部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
甲同学设计了如下除杂方案:
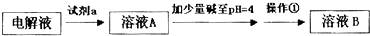
(1)试剂a是
(2)乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水调节pH至7~8,可使Fe3+生成Fe(OH)3沉淀而除去.”乙同学认为甲同学的方案中也应该将溶液pH调至7~8,你认为乙同学的建议是否正确?
查看习题详情和答案>>
Ⅰ、写出精炼粗铜过程中阳极上发生的电极反应
Fe-2e-=Fe2+、Zn-2e-=Zn2+、Cu-2e-=Cu2+
Fe-2e-=Fe2+、Zn-2e-=Zn2+、Cu-2e-=Cu2+
Ⅱ、精炼过程中需定时除去其中的Fe2+、Zn2+.下表为部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀 | 3.9. | 9.7 | 6.4 | 8.0 |
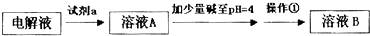
(1)试剂a是
H2O2
H2O2
,其目的是将Fe2+氧化为Fe3+
将Fe2+氧化为Fe3+
;根据上表数据该方案能够除去的杂质金属阳离子是Fe2+
Fe2+
.写出检验该杂质金属阳离子的操作方法:先加入KSCN溶液,若溶液不变红,再滴入几滴氯水,若溶液变成红色,说明含有该离子
先加入KSCN溶液,若溶液不变红,再滴入几滴氯水,若溶液变成红色,说明含有该离子
.(2)乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水调节pH至7~8,可使Fe3+生成Fe(OH)3沉淀而除去.”乙同学认为甲同学的方案中也应该将溶液pH调至7~8,你认为乙同学的建议是否正确?
否
否
(填“是”或“否”),理由是根据沉淀时的pH,当溶液pH为7~8时,溶液A中Cu2+同时生成沉淀而被除去
根据沉淀时的pH,当溶液pH为7~8时,溶液A中Cu2+同时生成沉淀而被除去
.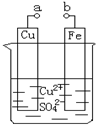 (2012?房山区二模)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
(2012?房山区二模)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )