题目内容
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ?mol-1.
当该反应有0.2mol SO2生成时,反应释放出的热量为
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.
T1温度下,反应进行到状态D时,v(正)
温度为T1时,反应的平衡常数K=
若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是
a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
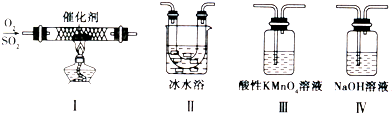
(3)为了验证SO2既具有还原性还具有酸性氧化物的性质,下列试剂中能选取的合适实验试剂依次是
a.品红溶液 b.澄清的石灰水 c.烧碱溶液 d.溴水
(4)实验室存放的Na2SO3溶液容易变质,请完成下列检验该Na2SO3溶液是否变质的实验报告:
①步骤一:用试管取适量的待测溶液;
②步骤二:向所取溶液中
③实验现象及对应结论:
(2))状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行;
根据SO3平衡时的浓度,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数k=
| c2(SO3) |
| c2(SO2)×c(O2) |
在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2,平衡向正反应方向移动,放出的热量增大,等效为增大压强,平衡向正反应方向移动,反应物的转化率增大.平衡常数只与温度有关,由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动,平衡常数降低;
(3)选择由氧化性的试剂,检验二氧化硫的还原性,且现象明显;
选择碱溶液,检验二氧化硫是酸性氧化物,且现象明显;
(4)Na2SO3溶液变质,会有Na2SO4生成,取少许溶液加入用盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成确定是否变质.
| 0.2mol |
| 2mol |
故答案为:77.3;
(2)状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行,v正>v逆;
T1温度下,反应达到平衡状态,SO2的转化率为90%,则SO2的浓度变化为1mol/L×90%=0.9mol?L-1,
2SO2(g)+O2(g)?2SO3(g).
开始(mol/L):1 0.5 0
变化(mol/L):0.9 0.45 0.9
平衡(mol/L):0.1 0.05 0.9
所以该温度下平衡常数k=
| 0.92 |
| 0.12×0.05 |
在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2,平衡向正反应方向移动,放出的热量增大,等效为增大压强,平衡向正反应方向移动,反应物的转化率增大,故容器内压强小于原来的2倍,放出的热量Q2>Q1,故ab错误,c正确;平衡常数只与温度有关,由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动,平衡常数降低,故d错误;
故答案为:>;1620;c;
(3)溴水检验强氧化性,氧化二氧化硫,溶液颜色褪去,可以用溴水验证二氧化硫的还原性;
二氧化硫与氢氧化钠溶液、氢氧化钙溶液都放出反应生成亚硫酸盐与水,亚硫酸钠溶于水,亚硫酸钙为白色沉淀,故二氧化硫与氢氧化钠溶液反应选项不明显,可以用氢氧化钙溶液验证SO2具有酸性氧化物的性质,
故答案为:d;b;
检验二氧化硫是酸性氧化物,且现象明显;
(4)Na2SO3溶液变质,会有Na2SO4生成,取少许溶液加入用盐酸酸化的BaCl2溶液,若出现白色沉淀,则Na2SO3溶液变质,若不出现白色沉淀,则Na2SO3溶液未变质,
故答案为:加入用盐酸酸化的BaCl2溶液;若出现白色沉淀,则Na2SO3溶液变质,若不出现白色沉淀,则Na2SO3溶液未变质.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案研究硫及其化合物的性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol
当该反应有1.2mol电子转移时,反应释放出的热量为 kJ。
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。

①压强:P1 P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
|
气体 |
SO2 |
O2 |
SO3 |
|
浓度(mol/L) |
0.4 |
1.2 |
1.6 |
能说明该反应达到化学平衡状态的是 。
a.SO2和O2的体积比保持不变
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,υ(O2)= 。
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡
移动(填“向左”“向右”或“不”);若得到pH=3的H2SO3溶液,试计算溶液中 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
研究硫及其化合物的性质有重要意义。
 (1)Cu2S在高温条件下发生如下反应:
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H= -773kJ·mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为 kJ。
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g) ![]() 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
①压强:P1 P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是 。
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,υ(O2)= 。
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若得到pH=3的H2SO3溶液,试计算溶液中![]() 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
 (2013?临沂二模)研究硫及其化合物的性质有重要意义.
(2013?临沂二模)研究硫及其化合物的性质有重要意义.