题目内容
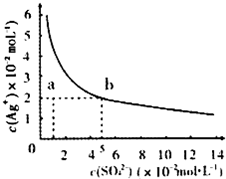 (2013?淄博一模)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
(2013?淄博一模)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )分析:Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),ksp=c2(Ag+)×c(SO42-),处于曲线上的点为饱和状态,不在曲线上的点为非饱和状态;
A.根据溶解为可逆过程;
B.加热蒸发时,溶液中银离子和硫酸根离子浓度都增大;
C.根据ksp=c2(Ag+)×c(SO42计算;
D.根据Qc=c2(Ag+)×c(SO42-)<ksp,不会生成沉淀;
A.根据溶解为可逆过程;
B.加热蒸发时,溶液中银离子和硫酸根离子浓度都增大;
C.根据ksp=c2(Ag+)×c(SO42计算;
D.根据Qc=c2(Ag+)×c(SO42-)<ksp,不会生成沉淀;
解答:解:A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A正确;
B.a点表示Ag2SO4的不饱和溶液,加热蒸发时,溶液中银离子和硫酸根离子浓度都增大,故B错误.
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;.
D.向AgNO3溶液中滴加Na2SO4溶液混合,若Qc=c2(Ag+)×c(SO42-)<ksp,不会生成沉淀,故D正确;
故选:D
B.a点表示Ag2SO4的不饱和溶液,加热蒸发时,溶液中银离子和硫酸根离子浓度都增大,故B错误.
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;.
D.向AgNO3溶液中滴加Na2SO4溶液混合,若Qc=c2(Ag+)×c(SO42-)<ksp,不会生成沉淀,故D正确;
故选:D
点评:本题考查难溶电解质的溶解平衡,题目难度中等,注意把握溶度积的计算,并以此判断溶液是否饱和,为解答该题的关

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?淄博一模)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(2013?淄博一模)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
 -OOCCH3
-OOCCH3

