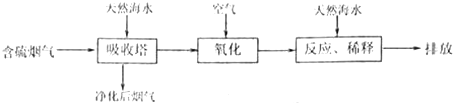
摘要:34.某工厂的燃料煤中含硫的质量分数为0.32%.该厂每天燃烧这种煤100t.试通过计算回答: (1)如果煤中的硫全部转化为.每天可产生的在标准状况下的体积为 , (2)如果用10mol/L的NaOH溶液吸收这些.使之完全转化为?每天需要消耗NaOH溶液的体积为 L.
网址:http://m.1010jiajiao.com/timu3_id_158088[举报]
硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物.
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.溶液由棕黄色变为浅绿色用离子方程式表示为 ,后又由浅绿色变为棕黄色的离子方程式为 .
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如图:
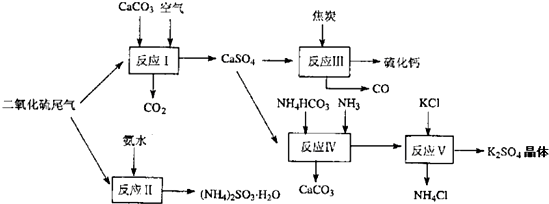
写出反应反应Ⅳ的化学方程式 ;
反应III中氧化剂与还原剂的物质的量之比为 ;
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是 .
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如图所示:
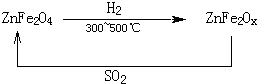
若2molZnFe2Ox与SO2反应可生成 0.75molS,x= ,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式 .某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏 t.
查看习题详情和答案>>
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.溶液由棕黄色变为浅绿色用离子方程式表示为
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如图:

写出反应反应Ⅳ的化学方程式
反应III中氧化剂与还原剂的物质的量之比为
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如图所示:

若2molZnFe2Ox与SO2反应可生成 0.75molS,x=
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式
(10分)下表是某城市某日的空气质量报告:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
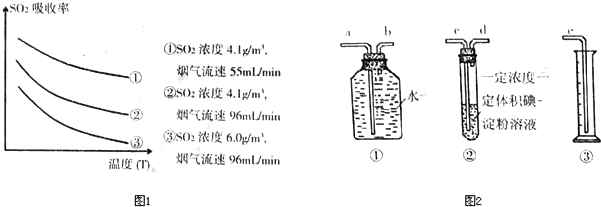
[探究实验一]用下图所示装置进行实验。
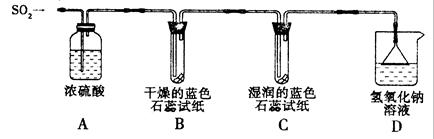
① A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸。
③ D装置的作用是 ,D中发生反应的化学方程式是 。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为 (填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为 m3。 查看习题详情和答案>>
(10分)下表是某城市某日的空气质量报告:
|
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
|
55 |
SO2 |
II |
良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
[探究实验一]用下图所示装置进行实验。
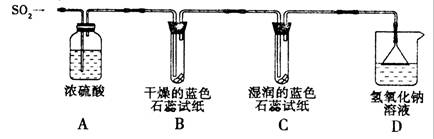
① A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸。
③ D装置的作用是 ,D中发生反应的化学方程式是 。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为 (填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为 m3。
查看习题详情和答案>>
(10分)下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
[探究实验一]用下图所示装置进行实验。
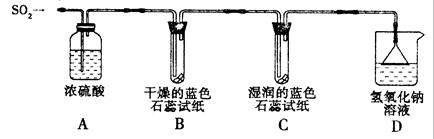
① A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸。
③ D装置的作用是 ,D中发生反应的化学方程式是 。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为 (填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为 m3。
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
[探究实验一]用下图所示装置进行实验。

① A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸。
③ D装置的作用是 ,D中发生反应的化学方程式是 。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为 (填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为 m3。