摘要:26.用黄铁矿可以制取硫酸.再用硫酸制取化肥硫酸铵.[2NH3+H2SO4=(NH4)2SO4].燃烧 含FeS2 80%的黄铁矿75 t.生产出79.2 t 硫酸铵.若在制取硫酸铵时硫酸的利用率为 90%.则用黄铁矿制取硫酸时的损失率为多少?
网址:http://m.1010jiajiao.com/timu3_id_158028[举报]
用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵。燃烧含FeS2为80%的黄铁矿75 t,生产出79.2 t硫酸铵。若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的损失率为__________。
查看习题详情和答案>>
用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵.今燃烧含PeS2为80%的黄铁矿75t,生产出79.2t硫酸铵.若在制取硫酸铵时硫酸的利用率为90%;则用黄铁矿制取硫酸时的损失率为________.
查看习题详情和答案>>用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵,今燃烧含 为80%的黄铁矿75t,生产出79.2t硫酸铵,若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的硫的损失率为多少?
为80%的黄铁矿75t,生产出79.2t硫酸铵,若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的硫的损失率为多少?
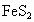 为80%的黄铁矿75t,生产出79.2t硫酸铵,若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的硫的损失率为多少?
为80%的黄铁矿75t,生产出79.2t硫酸铵,若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的硫的损失率为多少?