题目内容
用黄铁矿可以制硫酸,再用硫酸制取化肥硫酸铵。今燃烧含FeS2 80%的黄铁矿75 t,生产出79.2 t硫酸铵。若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制硫酸时的损失率是多少?
解析:设黄铁矿制硫酸的利用率为x。
由方程式(或S的守恒)得关系式:
FeS2 — 2(NH4)2SO4
120 2×132
75 t×80%×90%·x 79.2 t
解得:x=66.67%
FeS2的损失率为100%-66.67%=33.33%
答案:用黄铁矿制硫酸时的损失率是33.33%。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
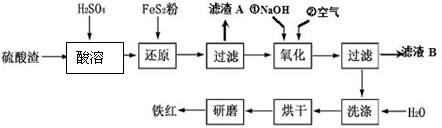
 和
和