摘要:VO2:VNO2==2:3或3:25
网址:http://m.1010jiajiao.com/timu3_id_157983[举报]
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:(1)关于能量变化的研究已知:
①2CH3OH(1)+3CO2(g)=2CO2(g)+4H2O(g)△H=-akjmol-
②CH3OH(1)+O2(g)=CO(g)+2H2O(1)△-bkjmol -
③H2O(g)=H2O(1)△H=-ckjmol-
则:2CO(g)+O2(g)=2CO2(g)△H=
(2)关于反应速率和限度的研究
①已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
②已知2SO2(g)+O2(g)?2SO3(g):△H=-196kjmol,在一个容积为2L的容器中加入2molSO2和lmol O2,在某温度下充分反应,经过30min达到平衡,放出热量176.94kJ.如果用SO2表示该反应的反应速率,则v(SO2)=
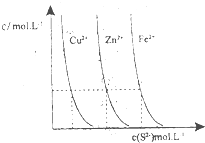
③图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是
(3)关于电化学的研究全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:VO2++2H++V2+
| 放电 |
| 通电 |
X~W是元素周期表中的短周期元素,其性质或结构信息如下表:
回答下列问题:
(1)X在元素周期表中的位置是
 .
.
(2)Z的单质特别稳定,原因在于
(3)X的氢化物和Z的氢化物反应形成的化合物溶于水,水溶液呈酸性的原因是
(4)WV2常温下呈液态,是一种常见的溶剂.已知WV2在氧气中完全燃烧,生成VO2和WO2,若0.1mol WV2在1mol O2中完全燃烧,所得气体混合物在标准状况下的体积为
(5)已知:①Z2(g)+O2(g)=2ZO(g)△H=+180kJ?mol-1;
②2ZO2(g)=Z2(g)+2O2(g)△H=-67.8kJ?mol-1.
则反应4ZO(g)=2ZO2(g)+Z2(g)的△H为
查看习题详情和答案>>
| 元素 | X | Y | Z | V | W |
| 性质 信息 |
单质为有色气体,有毒,可用于自来水消毒 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 其单质在空气中约占4/5左右 | 单质为淡黄色晶体,质脆,不溶于水,微溶于酒精 | 位于第IVA,是形成的化合物最多的元素之一 |
(1)X在元素周期表中的位置是
第三周期ⅦA族
第三周期ⅦA族
,V2-离子结构示意图为

(2)Z的单质特别稳定,原因在于
氮气分子中氮氮键为氮氮叁键,键长短,键能大,难断裂
氮气分子中氮氮键为氮氮叁键,键长短,键能大,难断裂
;X、Y和V三元素中原子半径最大的是X(或Cl)
X(或Cl)
.(3)X的氢化物和Z的氢化物反应形成的化合物溶于水,水溶液呈酸性的原因是
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
(用离子方程式说明).(4)WV2常温下呈液态,是一种常见的溶剂.已知WV2在氧气中完全燃烧,生成VO2和WO2,若0.1mol WV2在1mol O2中完全燃烧,所得气体混合物在标准状况下的体积为
22.4
22.4
L.(5)已知:①Z2(g)+O2(g)=2ZO(g)△H=+180kJ?mol-1;
②2ZO2(g)=Z2(g)+2O2(g)△H=-67.8kJ?mol-1.
则反应4ZO(g)=2ZO2(g)+Z2(g)的△H为
-292.2
-292.2
kJ?mol-1. (2013?安徽模拟)某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )
(2013?安徽模拟)某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )
查看习题详情和答案>>
(2009?肇庆二模)随材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.该工艺的主要流程如图1:

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
(1)23V在元素周期表位于第
(2)反应①的目的是
(3)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,其离子方程式为:
(4)已知NH4VO3在焙烧过程中150~200℃时先失去氨;在300~350℃再失去水.请在右边座标图2中画出加热234g NH4VO3固体质量的减少值△W随温度(T)变化的曲线.
查看习题详情和答案>>

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
四
四
周期ⅤB
ⅤB
族.工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式为3V2O5+10A
l6V+5Al2O3
| ||
3V2O5+10A
l6V+5Al2O3
.
| ||
(2)反应①的目的是
将V2O5转化为可溶性的VOSO4
将V2O5转化为可溶性的VOSO4
.(3)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,其离子方程式为:
2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O
2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O
.(4)已知NH4VO3在焙烧过程中150~200℃时先失去氨;在300~350℃再失去水.请在右边座标图2中画出加热234g NH4VO3固体质量的减少值△W随温度(T)变化的曲线.
 (2012?百色二模)某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO2-4,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )
(2012?百色二模)某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO2-4,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )