摘要:在标准状况下.750 mL含O3的O2.其中的O3若完全分解.其体积变为780 mL .若将该含有O3的O2 1 L.通入适量的KI溶液中发生如下反应 2KI+O3+H2O====2KOH+I2+O2↑. 求析出I2的质量是多少克? 解析:此题在巩固和认识O3性质的基础上以训练学生的解题方法和能力. 首先根据2O3====3O2反应.采用差量法(ΔV)求得气体中O3的体积分数.然后 据2KI+O3+H2O====2KOH+I2+O2↑反应.采用关系式法(这里为O3-I2)求得m(I2). 答案:0.91 g 17, 过氧化氢易分解.若在其水溶液中加入少量MnO2.可大大促进它的分解.因此可 用于实验室里制取O2.原理为不稳定2H2O22H2O+O2↑.请设计反应装置. 解析,根据反应物及催化剂的状态.反应条件选择反应容器. 根椐反应目的选择其他的辅助装置.因此本实验是固液不加 型的气体制备实验选用锥形瓶作反应容器如右图所示:
网址:http://m.1010jiajiao.com/timu3_id_157924[举报]
Fe和Al是两种重要的金属,将它们按一定的质量比组成混合物.
(1)取一定质量的该混合物,若加入足量的NaOH溶液,生成的气体在标准状况下体积为n L;若加入足量的稀硫酸,生成的气体在标准状况下体积为m L.则原混合物中Fe的物质的量为
mol(用含n、m的代数式表示).
(2)取一定质量的该混合物,在纯氧中充分燃烧.向所得产物中加入过量的NaOH溶液,充分反应后将不溶物过滤、洗涤、干燥后称量,测得该不溶物的质量与原混合物的质量恰好相等.则原混合物中Fe与Al的质量比为
查看习题详情和答案>>
(1)取一定质量的该混合物,若加入足量的NaOH溶液,生成的气体在标准状况下体积为n L;若加入足量的稀硫酸,生成的气体在标准状况下体积为m L.则原混合物中Fe的物质的量为
| m-n |
| 22.4 |
| m-n |
| 22.4 |
(2)取一定质量的该混合物,在纯氧中充分燃烧.向所得产物中加入过量的NaOH溶液,充分反应后将不溶物过滤、洗涤、干燥后称量,测得该不溶物的质量与原混合物的质量恰好相等.则原混合物中Fe与Al的质量比为
21:8
21:8
.如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
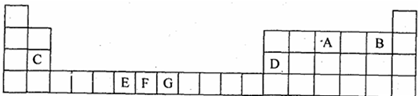
试回答下列问题:
(1)请写出元素E的基态原子电子排布式 ;
(2)F、G两元素的部分电离能数据列于下表:
比较两元素的I2、I3,气态F2+、G2+中, (元素符号表示)更难失去电子变为+3价气态离子;请用原子结构理论解释原因 .
(3)在标准状况下,根据M=
测定B的气态氢化物的相对分子质量,结果发现,测定结果总比理论值偏高,其原因是 .
(4)C、D的单质中, (用元素符号表示)熔点更高、硬度更大.
查看习题详情和答案>>

试回答下列问题:
(1)请写出元素E的基态原子电子排布式
(2)F、G两元素的部分电离能数据列于下表:
| 元素 | F | G | |
| 电离能 kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)在标准状况下,根据M=
| m |
| n |
(4)C、D的单质中,
下表为周期表的一部分,其中的字母代表对应的元素
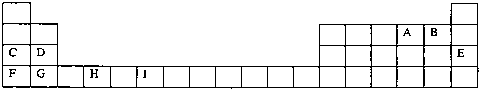
请回答下列问题:
(1)写出元素I的基态原子的价电子排布式 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)请列举F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .
(3)在标准状况下,根据M=
测定B的气态氢化物的相对分子质量,结果发现,测定结果总比理论值高,其原因是 .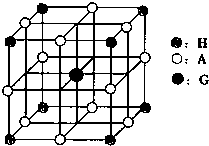
(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为 ;在该晶体中,G离子的配位数为 ;若晶胞的边长为acm,则晶体的密度为 g/cm3.
查看习题详情和答案>>

请回答下列问题:
(1)写出元素I的基态原子的价电子排布式
(2)请列举F的金属性比C强的实验事实:
(3)在标准状况下,根据M=
| m | n |

(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为