题目内容
如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
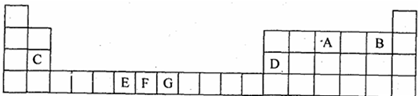
试回答下列问题:
(1)请写出元素E的基态原子电子排布式 ;
(2)F、G两元素的部分电离能数据列于下表:
比较两元素的I2、I3,气态F2+、G2+中, (元素符号表示)更难失去电子变为+3价气态离子;请用原子结构理论解释原因 .
(3)在标准状况下,根据M=
测定B的气态氢化物的相对分子质量,结果发现,测定结果总比理论值偏高,其原因是 .
(4)C、D的单质中, (用元素符号表示)熔点更高、硬度更大.

试回答下列问题:
(1)请写出元素E的基态原子电子排布式
(2)F、G两元素的部分电离能数据列于下表:
| 元素 | F | G | |
| 电离能 kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)在标准状况下,根据M=
| m |
| n |
(4)C、D的单质中,
分析:根据元素周期表来解题,根据在元素周期表中的位置,可以确定元素的种类,并可以写出元素的原子电子排布式,在书写副族元素的电子排布式时,对d电子层半充满和全充满的情况会有所调整,形成离子时,半充满结构较稳定;氟元素形成的氢化物氟化氢很稳定,是因为形成了分子氢键,分子氢键使分子的聚合度增大,质量与物质的量的比值会增大;常见元素镁和铝的物理性质中铝元素的熔点较高、硬度较大.
解答:解:(1)元素E为铬元素,位于第四周期,第ⅥB族,价电子有6个,其中5个填充在d电子层上,形成半充满结构,半充满结构比较稳定,
其基态原子电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(2)F、G两元素失去三个电子形成+3价离子,比较两者的第三电离能,可以看出锰较铁元素的数值大,说明锰失去第三个电子比较困难,Mn2+更难失去电子变为+3价气态离子,锰元素的原子电子排布式为1s22s22p63s23p63d54s2,Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;而铁的原子电子排布式为1s22s22p63s23p63d64s2,Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子,
故答案为:Mn2+;Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子;
(3)B元素为氟元素,形成的氢化物为氟化氢,因HF分子间会形成氢键,使分子发生聚合,使得质量与物质的量的比值增大,故答案为:因HF分子间会形成氢键;
(4)C为镁元素,D为铝元素,Al原子的半径小,电荷多,金属键强,则Al的熔点更高、硬度更大,故答案为:Al.
其基态原子电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(2)F、G两元素失去三个电子形成+3价离子,比较两者的第三电离能,可以看出锰较铁元素的数值大,说明锰失去第三个电子比较困难,Mn2+更难失去电子变为+3价气态离子,锰元素的原子电子排布式为1s22s22p63s23p63d54s2,Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;而铁的原子电子排布式为1s22s22p63s23p63d64s2,Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子,
故答案为:Mn2+;Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子;
(3)B元素为氟元素,形成的氢化物为氟化氢,因HF分子间会形成氢键,使分子发生聚合,使得质量与物质的量的比值增大,故答案为:因HF分子间会形成氢键;
(4)C为镁元素,D为铝元素,Al原子的半径小,电荷多,金属键强,则Al的熔点更高、硬度更大,故答案为:Al.
点评:本题考查了元素周期表中元素的位置,知道元素的位置反过来推测元素的种类和元素的核外电子排布,核外电子排布对副族元素来说要考虑d电子的半充满结构,形成离子时形成半充满结构较稳定,氟元素的化学性质和镁铝元素的物理性质.

练习册系列答案
相关题目
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |