网址:http://m.1010jiajiao.com/timu3_id_157195[举报]
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是______________。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为________,联氨的碱性比氨的碱性________(填“强”或“弱”),其原因是________________________________________________________________。
写出N2H4与N2O4反应的化学方程式:____________________。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示:
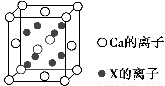
CaX2的晶体类型是________,一个晶胞中含有Ca的离子数为________,含有X的离子数为________。
查看习题详情和答案>>
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为 ,N—N键的键角为 。
(2)基态砷原子的最外层电子排布式为 。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是 。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为 ,联氨的碱性比氨的碱性 (填“强”或“弱”),其原因是 。
写出N2H4与N2O4反应的化学方程式: 。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示:

CaX2的晶体类型是 ,一个晶胞中含有Ca的离子数为 ,含有X的离子数为 。
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是______________。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为________,联氨的碱性比氨的碱性________(填“强”或“弱”),其原因是________________________________________________________________。
写出N2H4与N2O4反应的化学方程式:____________________。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示:

CaX2的晶体类型是________,一个晶胞中含有Ca的离子数为________,含有X的离子数为________。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Ⅰ.(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按11组成的常见液态化合物的稀液易被催化分解,其结构式为 ,它非常容易被一种日常常见过渡金属离子还原,在酸性条件的离子反应方程式为 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
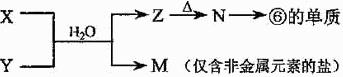
X溶液与Y溶液反应的离子方程式为 。常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 ;若Y与M混合则可使溶液呈碱性,此时溶液中离子浓度大小顺序为 。(填一种合理即可)
Ⅱ实验室制取③的氢化物的方程式为 ,已知该氢化物与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
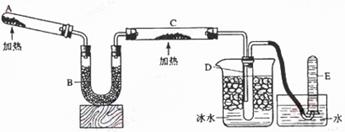
回答下列问题:
(1)B中加入的物质是 ,其作用是 。
(2)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(3)D中收集到的物质是 ,检验该物质的方法和现象是 。
查看习题详情和答案>>(23分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA |
| 0 | |||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 |
|
|
| ② | ③ | ④ |
|
|
3 | ⑤ |
| ⑥ | ⑦ |
|
| ⑧ |
|
Ⅰ.(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按11组成的常见液态化合物的稀液易被催化分解,其结构式为 ,它非常容易被一种日常常见过渡金属离子还原,在酸性条件的离子反应方程式为 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
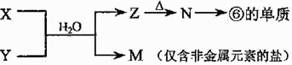
X溶液与Y溶液反应的离子方程式为 。常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 ;若Y与M混合则可使溶液呈碱性,此时溶液中离子浓度大小顺序为 。(填一种合理即可)
Ⅱ.实验室制取③的氢化物的方程式为 ,已知该氢化物与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
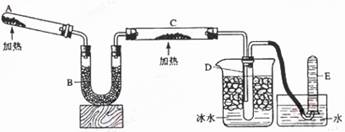
回答下列问题:
(1)B中加入的物质是 ,其作用是 。
(2)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(3)D中收集到的物质是 ,检验该物质的方法和现象是 。
查看习题详情和答案>>