网址:http://m.1010jiajiao.com/timu3_id_155955[举报]
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:
(3)A与D形成化合物的化学式为
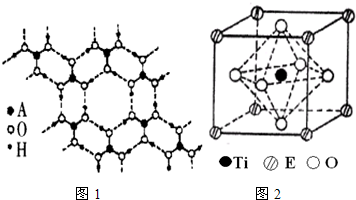
(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是![]() 。
。
查看习题详情和答案>>
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是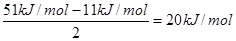 。
。
查看习题详情和答案>>
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 或
或 
 或
或 
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)写出⑥的最高价氧化物对应水化物的电离方程式
(1)元素B在周期表中的位置是
(2)C、D最低价氢化物稳定性的强弱顺序是
(3)在A、C、D组成的化合物中,既有离子键又有共价键的是
(4)在A、B、D中,由两种或三种元素组成两种可以反应的阴离子,该反应的离子方程式是
(5)化合物BA4D与O2、稀硫酸可组成燃料电池,此电池的负极反应式是
(6)在一定条件下,若有2.2kgBD2与足量A2恰好完全反应,生成气态的A2D和气态的BA4D,可放出2473.5kJ的热量,试写出该条件下发生反应的热化学方程式