摘要:化学式: 电子式: 结构式: 空间结构:
网址:http://m.1010jiajiao.com/timu3_id_155699[举报]
[化学-物质结构与性质]
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(2)已知:下表是14种元素的电负性的数值(用X表示).
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键,如NaCl;当小于1.7时,一般为共价键,如AlCl3.请写出铁元素和表中非金属元素形成的常见共价化合物:
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为
 .
.
③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)
查看习题详情和答案>>
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
[Ar]3d104s1
[Ar]3d104s1
,请解释金属铜能导电的原因铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电.
铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电.
.②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
bc
bc
.a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
离子键、配位键
离子键、配位键
.(2)已知:下表是14种元素的电负性的数值(用X表示).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
FeCl3或FeS
FeCl3或FeS
.②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为


③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)
CO2或CS2
CO2或CS2
,其分子空间构型为直线型
直线型
.化学--选修物质结构与性质
下面是C60、金刚石和二氧化碳的分子模型.
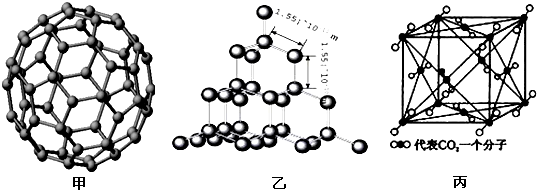
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:
(2)从晶体类型来看,C60属于
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子.观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个.实际上一个二氧化碳晶胞中含有
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一.丙烷分子中2号碳原子的杂化方式是
查看习题详情和答案>>
下面是C60、金刚石和二氧化碳的分子模型.

请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:
1s22s22p63s23p2
1s22s22p63s23p2
(2)从晶体类型来看,C60属于
分子
分子
晶体.(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子.观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是
6
6
;晶体硅中硅原子与共价键的个数比为1:2
1:2
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个.实际上一个二氧化碳晶胞中含有
4
4
个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为1:1
1:1
.(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一.丙烷分子中2号碳原子的杂化方式是
sp3
sp3
,丙烯分子中2号碳原子的杂化方式是sp2
sp2
,丙烯分子中最多有7
7
个原子共平面. 化学-物质结构
化学-物质结构氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.
请回答下列问题:
(1)写出铬原子的基态电子排布式
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu
K、Cu
(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4
4
,配位数为12
12
.(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
非极性
非极性
(填“极性”或“非极性”)分子.(3)在①苯 ②CH3OH ③HCHO ④CS2⑤CCl4⑥CH3Cl ⑦HCOOH七种有机物质中,碳原子采取sp2杂化的分子有
①③⑦
①③⑦
(填序号),CS2分子的空间构型是直线形
直线形
.[化学-物质结构与性质]

Ⅰ.短周期某主族元素M的电离能如图(A)所示.则M元素位于周期表的第
Ⅱ.图B折线c可以表达出第
Ⅲ.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)写出这三种元素电负性由大到小的顺序
(2)砷原子核外电子排布式为
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为
查看习题详情和答案>>

Ⅰ.短周期某主族元素M的电离能如图(A)所示.则M元素位于周期表的第
ⅡA
ⅡA
族.Ⅱ.图B折线c可以表达出第
IVA
IVA
族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b
b
(填“a”或“b”)Ⅲ.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)写出这三种元素电负性由大到小的顺序
N>P>As
N>P>As
(填元素符号)(2)砷原子核外电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为
配位键
配位键
,该化学 键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)
CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)
.[化学--物质结构与性质]
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等.
回答以下问题:
(1)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是 .
(2)C、N、O三种元素第一电离能从大到小的顺序是 .
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被一NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是 ; N2H4分子中氮原子轨道的杂化类型是
(4)胼能与硫酸反应生成N2H6S04.N2H6S04晶体类型与硫酸铵相同,则N2H6S04的晶体内不存在 (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(5)NH3、N2H4、NH4+、N2H62+四种微粒中,能形成氢键的有 ;不能作为配位体的有 .
查看习题详情和答案>>
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等.
回答以下问题:
(1)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被一NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
(4)胼能与硫酸反应生成N2H6S04.N2H6S04晶体类型与硫酸铵相同,则N2H6S04的晶体内不存在
a.离子键 b.共价键 c.配位键 d.范德华力
(5)NH3、N2H4、NH4+、N2H62+四种微粒中,能形成氢键的有