摘要:A.B.C为短周期元素.A.C最低价离子分别为A2- .C-.离子半径A2- >C-.又知B2+和C-的电子层结构相同.下列叙述中不正确的是 A.它们的原子序数:A>B>C B.原子半径:C<A<B C.离子半径:A2- >C- >B2+ D.原子最外层上的电子数:C>A>B
网址:http://m.1010jiajiao.com/timu3_id_155465[举报]
三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法正确的是( )
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
查看习题详情和答案>>|
三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法正确的是 | |
A. |
原子序数:A>B>C |
B. |
原子半径:A>B>C |
C. |
离子半径:A2->C->B2+ |
D. |
原子核外最外层电子数:A>C>B |
短周期元素X、Y、Z,X元素最高正价与最低负价的绝对值之差等于4;Y元素的原子半径是短周期中最大的,金属Z的单质能够溶于Y的水溶液.元素X的单质与元素Z的单质在加热条件下反应生成化合物A,A溶于水生成白色沉淀B和气体C,B也能溶于Y的水溶液.C在足量空气中燃烧生成的刺激性气体D是酸雨的主要成分.C被足量Y的水溶液吸收得到无色溶液E.溶液E在空气中长期放置发生反应,生成物之一F与过氧化钠的结构和化学性质相似.
请回答下列问题:
(1)元素X位于周期表中第
(2)F的电子式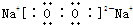
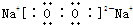
(3)Z与Y水溶液反应的离子方程式为
(4)D与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.该反应的氧化产物为
(5)F的溶液与稀硫酸反应产生的现象为
查看习题详情和答案>>
请回答下列问题:
(1)元素X位于周期表中第
三
三
周期,第VIA
VIA
族.(2)F的电子式
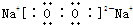
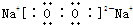
(3)Z与Y水溶液反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(4)D与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.该反应的氧化产物为
硫酸钠(Na2SO4)
硫酸钠(Na2SO4)
,当生成2mol二氧化氯时,转移电子2
2
mol.(5)F的溶液与稀硫酸反应产生的现象为
溶液由黄色变为无色,产生浅黄色沉淀和(臭鸡蛋气味的)气体
溶液由黄色变为无色,产生浅黄色沉淀和(臭鸡蛋气味的)气体
.短周期元素a、b、c、d、e、f、g、h的原子序数依次增大.其中a是原子半径最小的原子,a和e、c和g、d和h同主族.b元素的最高正价和最低负价的绝对值之差为2; e单质能与冷水剧烈反应生成H2;f原子最外层电子数等于其周期序数;h-的电子层结构与Ar原子相同.
(1)f原子结构示意图为 ;d和e形成的化合物电子式为 ;
(2)c和f简单离子的半径大小为 ;(用离子符号和“>”“=”或“<”表示)
(3)c与g的气态氢化物沸点较高的是 (填氢化物 分子式),原因是 .
(4)元素非金属性强弱的比较有很多方法,其中g和h的非金属性强弱的研究方案中不可行的是 (填序号);
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较两种单质常温下的状态 ④比较最高价氧化物对应水化物的酸性
⑤由g和h的相互制备情况进行判断
(5)写出e、f的最高价氧化物对应水化物间反应的离子方程式 .
查看习题详情和答案>>
(1)f原子结构示意图为
(2)c和f简单离子的半径大小为
(3)c与g的气态氢化物沸点较高的是
(4)元素非金属性强弱的比较有很多方法,其中g和h的非金属性强弱的研究方案中不可行的是
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较两种单质常温下的状态 ④比较最高价氧化物对应水化物的酸性
⑤由g和h的相互制备情况进行判断
(5)写出e、f的最高价氧化物对应水化物间反应的离子方程式