摘要:27.金刚石和晶体硅是 晶体, 因为硅中的Si-Si键长比金刚石中的C-C键长 , 而Si-Si键能比C-C键能 , 故晶体硅的硬度和熔点都比金刚石 .
网址:http://m.1010jiajiao.com/timu3_id_155309[举报]
几种常见晶体的物理性质见下表,请完成表中空格
(1)金刚石的同素异形体是
(2)上述晶体中熔化成液态时无需破坏化学键的是
(3)金刚石和二氧化硅硬度大、熔点高的主要是因为晶体中的原子以共价键结合成
查看习题详情和答案>>
| 晶 体 | 氯化钠 | 氯化钡 | 金刚石 | 二氧化硅 | 硫 | 白磷 | 钠 | 钨 |
| 熔点 0C | 801 | 1560 | 3550 | 1723 | 112.8 | 44.1 | 97.8 | 3410 |
| 硬 度 | 较 硬 | 较 硬 | 很 硬 | 硬 脆 | 脆 | 软 | 柔 软 | 硬 |
| 晶体类 型 | ||||||||
石墨
石墨
(2)上述晶体中熔化成液态时无需破坏化学键的是
分子晶体
分子晶体
,从熔点、硬度看规律性最差的是金属晶体
金属晶体
,晶体中存在分子的是分子晶体
分子晶体
(本小题各空匀填写晶体类别)(3)金刚石和二氧化硅硬度大、熔点高的主要是因为晶体中的原子以共价键结合成
空间网状结构
空间网状结构
.二氧化硅和二氧化碳都是ⅣA族元素的氧化物但它们的物理性质相差很大,这主要是因为它们的晶体类别
晶体类别
不同.由分子构成的物质,影响其熔沸点和溶解度的重要因素之一是范德华力
范德华力
.几种常见晶体的物理性质见下表,请完成表中空格
(1)金刚石的同素异形体是______
(2)上述晶体中熔化成液态时无需破坏化学键的是______,从熔点、硬度看规律性最差的是______,晶体中存在分子的是______(本小题各空匀填写晶体类别)
(3)金刚石和二氧化硅硬度大、熔点高的主要是因为晶体中的原子以共价键结合成______.二氧化硅和二氧化碳都是ⅣA族元素的氧化物但它们的物理性质相差很大,这主要是因为它们的______不同.由分子构成的物质,影响其熔沸点和溶解度的重要因素之一是______.
查看习题详情和答案>>
| 晶 体 | 氯化钠 | 氯化钡 | 金刚石 | 二氧化硅 | 硫 | 白磷 | 钠 | 钨 |
| 熔点 0C | 801 | 1560 | 3550 | 1723 | 112.8 | 44.1 | 97.8 | 3410 |
| 硬 度 | 较 硬 | 较 硬 | 很 硬 | 硬 脆 | 脆 | 软 | 柔 软 | 硬 |
| 晶体类 型 | ||||||||
(2)上述晶体中熔化成液态时无需破坏化学键的是______,从熔点、硬度看规律性最差的是______,晶体中存在分子的是______(本小题各空匀填写晶体类别)
(3)金刚石和二氧化硅硬度大、熔点高的主要是因为晶体中的原子以共价键结合成______.二氧化硅和二氧化碳都是ⅣA族元素的氧化物但它们的物理性质相差很大,这主要是因为它们的______不同.由分子构成的物质,影响其熔沸点和溶解度的重要因素之一是______.
几种常见晶体的物理性质见下表,请完成表中空格
(1)金刚石的同素异形体是______
(2)上述晶体中熔化成液态时无需破坏化学键的是______,从熔点、硬度看规律性最差的是______,晶体中存在分子的是______(本小题各空匀填写晶体类别)
(3)金刚石和二氧化硅硬度大、熔点高的主要是因为晶体中的原子以共价键结合成______.二氧化硅和二氧化碳都是ⅣA族元素的氧化物但它们的物理性质相差很大,这主要是因为它们的______不同.由分子构成的物质,影响其熔沸点和溶解度的重要因素之一是______.
查看习题详情和答案>>
| 晶 体 | 氯化钠 | 氯化钡 | 金刚石 | 二氧化硅 | 硫 | 白磷 | 钠 | 钨 |
| 熔点 0C | 801 | 1560 | 3550 | 1723 | 112.8 | 44.1 | 97.8 | 3410 |
| 硬 度 | 较 硬 | 较 硬 | 很 硬 | 硬 脆 | 脆 | 软 | 柔 软 | 硬 |
| 晶体类 型 | ||||||||
(2)上述晶体中熔化成液态时无需破坏化学键的是______,从熔点、硬度看规律性最差的是______,晶体中存在分子的是______(本小题各空匀填写晶体类别)
(3)金刚石和二氧化硅硬度大、熔点高的主要是因为晶体中的原子以共价键结合成______.二氧化硅和二氧化碳都是ⅣA族元素的氧化物但它们的物理性质相差很大,这主要是因为它们的______不同.由分子构成的物质,影响其熔沸点和溶解度的重要因素之一是______.
[化学-选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为
(2)硅主要以硅酸盐、
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
(6)在硅酸盐中,SiO
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
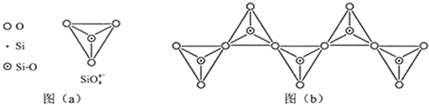
查看习题详情和答案>>
硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为
M
M
,该能层具有的原子轨道数为9
9
、电子数为4
4
.(2)硅主要以硅酸盐、
二氧化硅
二氧化硅
等化合物的形式存在于地壳中.(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以
共价键
共价键
相结合,其晶胞中共有8个原子,其中在面心位置贡献3
3
个原子.(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
.(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
.②SiH4的稳定性小于CH4,更易生成氧化物,原因是
C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键
C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键
.(6)在硅酸盐中,SiO
4- 4 |
sp3
sp3
,Si与O的原子数之比为1:3
1:3
,化学式为SiO32-
SiO32-
.
下列说法中正确的是( )
| A、金刚石、碳化硅、晶体硅的熔点依次升高 | B、甲酸甲酯和乙酸的分子式相同,它们的沸点相近 | C、水加热到很高的温度都难以分解是因为水分子间存在氢键 | D、固态时的熔点:HF>HCl>CO>N2 |