摘要:16.根据1〜8号的元素单质及其化学物的性质.在下列空格处填写元素符号或化学式: (1) 元素原子半径最小. 元素原子半径最大. (2)金属性最强的元素是 .非金属性最强的元素是 . (3)最稳定的气态氢化物是 .
网址:http://m.1010jiajiao.com/timu3_id_155128[举报]
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
(1)已知:物质的能量越高越不稳定,根据表中的数据,比较正丁烷、异丁烷的热稳定性:正丁烷 异丁烷(填“>”、“=”或“<”).
(2)写出乙烷燃烧的热化学方程式:
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量 (填“越多”、“越少”或“相同”).
查看习题详情和答案>>
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2-甲基丁烷 | 3 531.3 |
(2)写出乙烷燃烧的热化学方程式:
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量
 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.(1)实验前用碱液清洗铁钉,再用0.100mol/L的 H2SO4溶液浸泡至有气泡产生.用H2SO4溶液浸泡的目 的是
(2)为尽量减小误差,下列操作的正确顺序是
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为
(4)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH
假设二: NaCl溶液的浓度
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
| pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
| 液柱高度 | 0cm | 1.3cm | 8.5cm | 8.4cm | 8.5cm | 8.5cm |
| 形成稳定液柱时间 | 3.0min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | 17.5 min |
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是
③按上述实验装置,设计实验证明假设二.
第一步:
第二步:
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论.
(2013?闵行区一模)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2?yCuCO3.孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2?CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol/L Cu(NO3)2溶液、2.0mL 0.50mol/L NaOH溶液和0.25mol/L Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
表一:
表二:
(1)实验室制取少许孔雀石,应该采用的最佳反应条件:①Cu(NO3)2溶液与Na2CO3溶液的体积比为
(2)80℃时,所制得的孔雀石有少量褐色物质的原因是

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K1、K2,关闭K3,鼓入空气,一段时间后关闭活塞K1、K2,打开K3,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:
步骤5:称量相关装置的质量.
(3)装置A的作用是
(4)某同学在实验过程中采集了如下数据:
a.反应前玻璃管与样品的质量163.8g
b.反应后玻璃管中残留固体质量56.0g
c.装置C实验后增重9.0g
d.装置D实验后增重8.8g
为测定x/y的比值,你认为可以选用上述所采集数据中的
(5)根据你的计算结果,写出该样品组成的化学式
查看习题详情和答案>>
实验1:将2.0mL 0.50mol/L Cu(NO3)2溶液、2.0mL 0.50mol/L NaOH溶液和0.25mol/L Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
表一:
| 编号 | V (Na2CO3)/mL | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 |
| 3 | 2.0 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 |
| 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 40 | 多、蓝色 |
| 2 | 60 | 少、浅绿色 |
| 3 | 75 | 较多、绿色 |
| 4 | 80 | 较多、绿色(少量褐色) |
1:1
1:1
;②反应温度是75℃
75℃
.(2)80℃时,所制得的孔雀石有少量褐色物质的原因是
Cu(OH)2受热分解为CuO
Cu(OH)2受热分解为CuO
.实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K1、K2,关闭K3,鼓入空气,一段时间后关闭活塞K1、K2,打开K3,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:
打开K1,继续通一段时间空气至装置冷却
打开K1,继续通一段时间空气至装置冷却
.步骤5:称量相关装置的质量.
(3)装置A的作用是
除去空气中的CO2和H2O
除去空气中的CO2和H2O
;若无装置E,则实验测定的x/y的比值将偏小
偏小
(选填“偏大”、“偏小”或“无影响”).(4)某同学在实验过程中采集了如下数据:
a.反应前玻璃管与样品的质量163.8g
b.反应后玻璃管中残留固体质量56.0g
c.装置C实验后增重9.0g
d.装置D实验后增重8.8g
为测定x/y的比值,你认为可以选用上述所采集数据中的
bc、bd、cd
bc、bd、cd
(写出所有组合的字母代号)一组即可进行计算.(5)根据你的计算结果,写出该样品组成的化学式
5Cu(OH)2?2CuCO3
5Cu(OH)2?2CuCO3
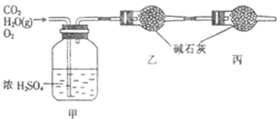
.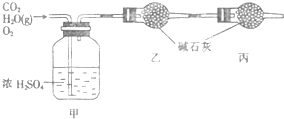 已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).
已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 86.4 |
(1)该燃料完全燃烧生成水的质量为
2.7
2.7
g,生成CO2的质量为4.4
4.4
g.(2)该燃料分子中碳、氢原子的数目比为
1:3
1:3
.(3)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为
C2H6O
C2H6O
,结构简式为CH3CH2OH(或CH3OCH3)
CH3CH2OH(或CH3OCH3)
.