题目内容
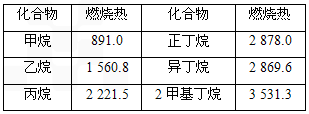
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2-甲基丁烷 | 3 531.3 |
(2)写出乙烷燃烧的热化学方程式:
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量
分析:燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量.一般C→CO2,H→H2O(l),S→SO2,燃烧热是物质的性质,可燃物为1mol,产物为稳定氧化物.
(1)依据图表给出的燃烧热数值比较正丁烷、异丁烷能量高低判断;
(2)依据表中乙烷燃烧热(kJ/mol)数据,求出2mol乙烷完全燃烧时放出的热量,以此写出热化学方程式;
(3)分别计算出甲烷、乙烷、丙烷含碳量,去等质量的三种烷烃比较完全燃烧放出的热量.
(1)依据图表给出的燃烧热数值比较正丁烷、异丁烷能量高低判断;
(2)依据表中乙烷燃烧热(kJ/mol)数据,求出2mol乙烷完全燃烧时放出的热量,以此写出热化学方程式;
(3)分别计算出甲烷、乙烷、丙烷含碳量,去等质量的三种烷烃比较完全燃烧放出的热量.
解答:解:(1)从图表给出的数据可知1mol正丁烷完全燃烧放出的热量为2 878.0KJ,1mol异丁烷完全燃烧放出的热量为2 869.6KJ,说明1mol正丁烷比1mol异丁烷所含能量高了9.4KJ,能量越高越不稳定,所以正丁烷稳定性小于异丁烷,
故答案为:<;
(2)依据表中乙烷燃烧热(kJ/mol)数据,可知1mol乙烷完全燃烧生成稳定的氧化物放出热量1 560.8KJ,则2mol乙烷完全燃烧放出热量为2×1 560.8KJ
=3121.6KJ,乙烷燃烧是放热反应,△H<0,则乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3121.6kJ/mol,
故答案为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3121.6kJ/mol;
(3)甲烷的含碳量为
×100%=75%、乙烷的含碳量为
×100%=80%、丙烷的含碳量为
×100%=81.8%,
取三种烷烃各1g,则依据燃烧热数据表计算各自完全燃烧放出的热量:
甲烷 Q1 乙烷 Q2 丙烷 Q3
16g 891.0 KJ 30g 1 560.8KJ 44g 2 221.5KJ
1g 55.69KJ 1g 52.02KJ 1g 50.49KJ
比较可知,甲烷、乙烷、丙烷含碳量依次增大,相同质量的甲烷、乙烷、丙烷完全燃烧放出的热量依次减小,所以相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,故答案为:越少.
故答案为:<;
(2)依据表中乙烷燃烧热(kJ/mol)数据,可知1mol乙烷完全燃烧生成稳定的氧化物放出热量1 560.8KJ,则2mol乙烷完全燃烧放出热量为2×1 560.8KJ
=3121.6KJ,乙烷燃烧是放热反应,△H<0,则乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3121.6kJ/mol,
故答案为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3121.6kJ/mol;
(3)甲烷的含碳量为
| 12 |
| 16 |
| 24 |
| 30 |
| 36 |
| 44 |
取三种烷烃各1g,则依据燃烧热数据表计算各自完全燃烧放出的热量:
甲烷 Q1 乙烷 Q2 丙烷 Q3
16g 891.0 KJ 30g 1 560.8KJ 44g 2 221.5KJ
1g 55.69KJ 1g 52.02KJ 1g 50.49KJ
比较可知,甲烷、乙烷、丙烷含碳量依次增大,相同质量的甲烷、乙烷、丙烷完全燃烧放出的热量依次减小,所以相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,故答案为:越少.
点评:本题考查了燃烧热的含义,依据能量高低判断物质的稳定性,热化学方程式的书写和烷烃燃烧时放热规律,题目难度不大,书写热化学方程式时应注意焓变符号的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
|
化合物 |
燃烧热 |
化合物 |
燃烧热 |
|
甲烷 |
891.0 |
正丁烷 |
2 878.0 |
|
乙烷 |
1 560.8 |
异丁烷 |
2 869.6 |
|
丙烷 |
2 221.5 |
2甲基丁烷[来源:学+科+网Z+X+X+K] |
3 531.3 |
(1)物质的能量越高越不稳定,比较正丁烷、异丁烷的热稳定性:正丁烷________异丁烷(填“>”或“<”)。
(2)写出表示乙烷燃烧热的热化学方程式:_________________________________
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量________(填“越多”“越少”或“相同”)。
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
(1)物质的能量越高越不稳定,比较正丁烷、异丁烷的热稳定性:正丁烷________异丁烷(填“>”或“<”)。
(2)写出表示乙烷燃烧热的热化学方程式:_________________________________
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量________(填“越多”“越少”或“相同”)。