题目内容
已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).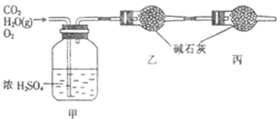
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为

| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 86.4 |
(1)该燃料分子中碳、氢原子的数目比为
1:3
1:3
.(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为
C2H6O
C2H6O
.分析:在有机物的燃烧试验中,有机物中的碳元素全部转化为二氧化碳,氢元素全部转化为水,浓硫酸增重量即为生成水的质量,碱石灰增加的质量即为二氧化碳的质量,根据碳元素和氢元素守恒来确定有机物的组成和原子数目,结合相对分子质量来确定分子式.
解答:解:(1)根据题意,浓硫酸增加的质量是103.8g-101.1g=2.7g,所以有机物燃烧生成水的物质的量为
=0.15mol,碱石灰增加的质量:86.4g-82.0g=4.4g,所以有机物燃烧生成二氧化碳的质量为:
=0.1mol,根据元素守恒,则该燃料分子中碳、氢原子的数目比为0.1:0.3=1:3,故答案为:1:3;
(2)该燃料分子的式量为46,每个分子中含有1个氧原子,则碳原子和氢原子的总是量为30,根据碳、氢原子的数目比为3:1,所以碳原子数目为2,氢原子数目为6,其分子式为C2H6O,故答案为:C2H6O.
| 2.7g |
| 18g/mol |
| 4.4g |
| 44g/mol |
(2)该燃料分子的式量为46,每个分子中含有1个氧原子,则碳原子和氢原子的总是量为30,根据碳、氢原子的数目比为3:1,所以碳原子数目为2,氢原子数目为6,其分子式为C2H6O,故答案为:C2H6O.
点评:有机物的燃烧法和元素守恒法是确定有机物分子式的简单方法,注意平时知识的积累是解题的关键,难度不大.

练习册系列答案
相关题目
【(6分)已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收)。
| | 实验前 | 实验后 |
| 甲的质量 / g | 101.1 | 103.8 |
| 乙的质量 / g | 82.0 | 86.4 |
(1)该燃料分子中碳、氢原子的数目比为 。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为 。
(6分)已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收)。

|
|
实验前 |
实验后 |
|
甲的质量 / g |
101.1 |
103.8 |
|
乙的质量 / g |
82.0 |
86.4 |
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为 。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为
【(6分)已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收)。

|
|
实验前 |
实验后 |
|
甲的质量 / g |
101.1 |
103.8 |
|
乙的质量 / g |
82.0 |
86.4 |
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为 。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为 。
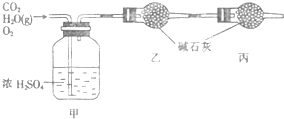 已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).
已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收).