摘要:14.⑴随着原子序数增大.E值变小 周期性 ⑵ ①③ ⑶ 419kJ/mol<E<738kJ/mol ⑷该元素原子的最外层电子排布已达到8电子稳定结构 课时三:
网址:http://m.1010jiajiao.com/timu3_id_154917[举报]
(2000?上海)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示.试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题.

(1)同主族内不同元素的E值变化的特点是:
(2)同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常.现试预测下列关系式中正确的是
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:
(4)10号元素E值较大的原因是
查看习题详情和答案>>

(1)同主族内不同元素的E值变化的特点是:
随着原子序数增大,E值变小
随着原子序数增大,E值变小
.各主族中E值的这种变化特点体现了元素性质的周期性
周期性
变化规律.(2)同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常.现试预测下列关系式中正确的是
①③
①③
(填写编号)①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:
419
419
<E<738
738
.(4)10号元素E值较大的原因是
该元素原子的最外层电子排布已达到8电子稳定结构.
该元素原子的最外层电子排布已达到8电子稳定结构.
.不同元素的气态原子失去最外层一个电子所需要的能量(设为E)如下表所示.试根据元素在元素周期表中的位置,分析表中的数据的变化特点,并回答下列问题:
(1)同主族内不同元素的E值变化的特点是
(2)同周期内,随着原子序数的递增,E值增大,但个别元素的E值出现反常现象.试预测下列关系正确的是
①E(As)>E(Se) ②E(As)<E(Se) ③E(Br)>E(Se) ④E(Br)<E(Se)
(3)第10号元素E值较大的原因是
(4)第7号元素和第8号元素的E值出现反常的原因
查看习题详情和答案>>
| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| E/eV | 13.4 | 24.6 | 5.4 | 9.3 | 8.3 | 11.3 | 14.5 | 13.6 | 17.4 | 21.6 |
| 原子序数 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| E/eV | 5.1 | 7.6 | 6.0 | 8.1 | 11.0 | 10.4 | 13.0 | 15.8 | 4.3 |
随着原子序数增大,E值变小
随着原子序数增大,E值变小
;各主族中E值的这种变化的特点体现了元素性质的周期性
周期性
变化规律.(2)同周期内,随着原子序数的递增,E值增大,但个别元素的E值出现反常现象.试预测下列关系正确的是
①③
①③
(填序号).①E(As)>E(Se) ②E(As)<E(Se) ③E(Br)>E(Se) ④E(Br)<E(Se)
(3)第10号元素E值较大的原因是
10号元素是氖.该元素原子的最外层电子排布已达到8电子稳定结构
10号元素是氖.该元素原子的最外层电子排布已达到8电子稳定结构
;(4)第7号元素和第8号元素的E值出现反常的原因
N元素的2p轨道为半满状态属于稳定状态,不容易失去1个电子,所以N的第一电离能大于O的第一电离能
N元素的2p轨道为半满状态属于稳定状态,不容易失去1个电子,所以N的第一电离能大于O的第一电离能
. 根据元素周期表及周期律的知识回答下列问题:
根据元素周期表及周期律的知识回答下列问题:(1)与钠同周期且离子半径最小的元素位于周期表的第
(2)金属钠在一定条件下与氢气反应生成氢化钠(2Na+H2
| 一定条件 |
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是
a.碱性:NaOH>Mg(OH)2>Al(OH)3 b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
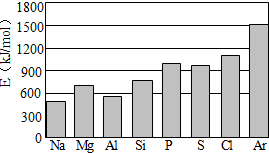
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:
①同周期内,随着原子序数的增大,E值变化的总趋势是
②根据上图提供的信息,试推断E氟
阅读下表中的部分短周期主族元素的相关信息
请回答下列问题:
(1)描述Z元素在周期表中的位置:
(2)T、X、Y元素简单离子半径由大到小的顺序为:(填离子符号)
(3)已知1mol 化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是
②根据上图提供的信息,试推断E氟
查看习题详情和答案>>
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期金属元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)描述Z元素在周期表中的位置:
第三周期第ⅦA族
第三周期第ⅦA族
(2)T、X、Y元素简单离子半径由大到小的顺序为:(填离子符号)
O2->Na+>Al3+
O2->Na+>Al3+
(3)已知1mol 化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式
SO32-+ClO-=SO42-+Cl-
SO32-+ClO-=SO42-+Cl-
.(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是
增大
增大
.②根据上图提供的信息,试推断E氟
>
>
E氧(填“>”“<”或“=”).