题目内容
 根据元素周期表及周期律的知识回答下列问题:
根据元素周期表及周期律的知识回答下列问题:(1)与钠同周期且离子半径最小的元素位于周期表的第
(2)金属钠在一定条件下与氢气反应生成氢化钠(2Na+H2
| 一定条件 |
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是
a.碱性:NaOH>Mg(OH)2>Al(OH)3 b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
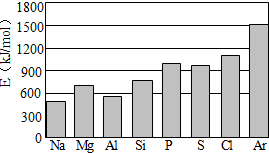
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:
①同周期内,随着原子序数的增大,E值变化的总趋势是
②根据上图提供的信息,试推断E氟
分析:(1)电子层越多微粒半径越大,核外电子数一样,核内质子数越少,半径越大;活泼的金属和活泼的非金属之间形成的化学键大多是离子键,构成的化合物为离子晶体;
(2)原子之间通过得失电子形成的化学键为离子键;
(3)同周期元素的原子从左到右,气态氢化物的稳定性逐渐增强,最高价氧化物对应水化物的碱性减弱、酸性增强,金属的活泼性减弱;
(4)同周期内,随着原子序数的增大,元素的气态原子失去最外层一个电子所需能量逐渐增大.
(2)原子之间通过得失电子形成的化学键为离子键;
(3)同周期元素的原子从左到右,气态氢化物的稳定性逐渐增强,最高价氧化物对应水化物的碱性减弱、酸性增强,金属的活泼性减弱;
(4)同周期内,随着原子序数的增大,元素的气态原子失去最外层一个电子所需能量逐渐增大.
解答:解:(1)根据微粒半径大小的比较方法:电子层越多微粒半径越大,核外电子数一样,核内质子数越少,半径越大,则与钠同周期且离子半径最小的是一种阳离子,故为铝离子,位于第ⅢA,活泼的金属铝和活泼的非金属氧之间形成的化学键是离子键,构成的化合物晶体类型为离子晶体,故答案为:ⅢA;离子;
(2)氢化钠是钠原子失去一个电子,氢原子得到这一个电子,均达到稳定结构的过程,原子之间通过得失电子形成的化学键为离子键,属于离子化合物,故答案为:Na+[:H]-;离子键;
(3)a、同周期元素的原子从左到右,最高价氧化物对应水化物的碱性减弱,故a正确;
b、同周期元素的原子从左到右,最高价氧化物对应水化物的酸性增强,故b错误;
c、同周期元素的原子从左到右,气态氢化物的稳定性逐渐增强,故c正确;
d、钠与镁和与NaOH溶液反应时,均是和其中的水反应,剧烈程度一样,故d错误;故答案为:ac;
(4)①根据第三周期元素的气态原子失去最外层一个电子所需能量(设为E)条形图可以看出:随着原子序数的增大,E值的总趋势是增大,故E氟>E氧,故答案为:随着原子序数的增大,E值的总趋势是增大;>.
(2)氢化钠是钠原子失去一个电子,氢原子得到这一个电子,均达到稳定结构的过程,原子之间通过得失电子形成的化学键为离子键,属于离子化合物,故答案为:Na+[:H]-;离子键;
(3)a、同周期元素的原子从左到右,最高价氧化物对应水化物的碱性减弱,故a正确;
b、同周期元素的原子从左到右,最高价氧化物对应水化物的酸性增强,故b错误;
c、同周期元素的原子从左到右,气态氢化物的稳定性逐渐增强,故c正确;
d、钠与镁和与NaOH溶液反应时,均是和其中的水反应,剧烈程度一样,故d错误;故答案为:ac;
(4)①根据第三周期元素的气态原子失去最外层一个电子所需能量(设为E)条形图可以看出:随着原子序数的增大,E值的总趋势是增大,故E氟>E氧,故答案为:随着原子序数的增大,E值的总趋势是增大;>.
点评:本题考查了元素周期表及周期律的知识,综合性较强,难度较大.

练习册系列答案
相关题目
 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
