摘要:写出下列反应的离子方程式 (1)硝酸银溶液中滴加氯化钠 (2)硫酸铜溶液中加氢氧化钡溶液 (3)实验室制取二氧化碳
网址:http://m.1010jiajiao.com/timu3_id_154855[举报]
写出下列反应的离子方程式:
(1)氢氧化钡溶液与硫酸铜溶液反应: 。
(2)碳酸钙固体中加入足量醋酸: 。
(3)锌和硝酸银溶液反应: 。
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性: 。
查看习题详情和答案>>(1)按要求写出下列反应的离子方程式
硫酸溶液中滴加氢氧化钡溶液
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是 ;能参与Zn反应生成氢气的是 ;能与硝酸和硝酸银的混合液作用生成白色沉淀的是 ;能使染料和有机色质褪色的是 .用滴管将新制的饱和氯水缓缓滴入预先滴有酚酞试液的NaOH溶液中,当滴到一定量时红色完全褪去.产生这种现象的原因可能有两种:a是 ;b是 .
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 ,在相同温度和相同压强条件下,体积最大的是 ,密度最小的是 .
②在 mL 0.2mol?L-1 NaOH溶液中含1g溶质;配制50mL 0.2mol?L-1 CuSO4溶液,需要CuSO4?5H2O g.
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是 ,还原剂是 ,耗1mol氧化剂,则被氧化的还原剂的物质的量是 mol.
查看习题详情和答案>>
硫酸溶液中滴加氢氧化钡溶液
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是
②在
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是
(1)按要求写出下列反应的离子方程式
硫酸溶液中滴加氢氧化钡溶液______
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是______;能参与Zn反应生成氢气的是______;能与硝酸和硝酸银的混合液作用生成白色沉淀的是______;能使染料和有机色质褪色的是______.用滴管将新制的饱和氯水缓缓滴入预先滴有酚酞试液的NaOH溶液中,当滴到一定量时红色完全褪去.产生这种现象的原因可能有两种:a是______;b是______.
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,密度最小的是______.
②在______mL0.2mol?L-1NaOH溶液中含1g溶质;配制50mL0.2mol?L-1CuSO4溶液,需要CuSO4?5H2O______g.
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是______,还原剂是______,耗1mol氧化剂,则被氧化的还原剂的物质的量是______mol.
查看习题详情和答案>>
硫酸溶液中滴加氢氧化钡溶液______
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是______;能参与Zn反应生成氢气的是______;能与硝酸和硝酸银的混合液作用生成白色沉淀的是______;能使染料和有机色质褪色的是______.用滴管将新制的饱和氯水缓缓滴入预先滴有酚酞试液的NaOH溶液中,当滴到一定量时红色完全褪去.产生这种现象的原因可能有两种:a是______;b是______.
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,密度最小的是______.
②在______mL0.2mol?L-1NaOH溶液中含1g溶质;配制50mL0.2mol?L-1CuSO4溶液,需要CuSO4?5H2O______g.
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是______,还原剂是______,耗1mol氧化剂,则被氧化的还原剂的物质的量是______mol.
指出下列反应的主要现象,并写出有关反应的离子方程式.
(1)向盛有硝酸银溶液的试管中滴加稀盐酸.
现象:_____________________________________;
离子方程式:_______________________________.
(2)向盛有硫酸铜溶液的试管中注入氢氧化钠溶液.
现象:_____________________________________;
离子方程式:_______________________________.
(3)向盛有氢氧化钠溶液和少许酚酞试液的试管中滴加稀硫酸.
现象:_____________________________________;
离子方程式:_______________________________.
(2010?扬州模拟)实验室用共沉淀法制备纳米级Fe3O4的流程如下: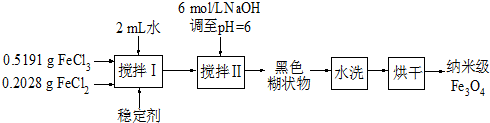
该方法的关键为促进晶粒形成,并控制晶体生长.试回答下列问题:
(1)该反应原理的离子方程式可表示为
(2)反应温度需控制在50℃,其方法是
(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,其作用是
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条)
查看习题详情和答案>>

该方法的关键为促进晶粒形成,并控制晶体生长.试回答下列问题:
(1)该反应原理的离子方程式可表示为
Fe2++2Fe3++8OH-=Fe3O4+4H2O
Fe2++2Fe3++8OH-=Fe3O4+4H2O
.(2)反应温度需控制在50℃,其方法是
水浴加热
水浴加热
,温度偏低造成产量低的可能是温度低时反应缓慢
温度低时反应缓慢
.(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,其作用是
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
.(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
.(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
.