网址:http://m.1010jiajiao.com/timu3_id_154594[举报]
(15分)纳米级Cu2 O 粉末,由于量子尺寸效应,其具有特殊的光学、电学及光电化学性质,在太阳电池、传感器、超导体、制氢和电致变色、环境中处理有机污染物等方面有着潜在的应用。
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g) N2(g)+2H2O(l)
△H=-a
kJ/mol
N2(g)+2H2O(l)
△H=-a
kJ/mol
Cu(OH)2(s) CuO(s)+H2O(l) △H=b kJ/mol
CuO(s)+H2O(l) △H=b kJ/mol
4CuO(s) 2Cu2O(s)+O2(g)
△H=c
kJ/mol
2Cu2O(s)+O2(g)
△H=c
kJ/mol
则该方法制备Cu2O的热化学方程式为 。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O Cu2O+H2↑,则阳极反应式为:
。
Cu2O+H2↑,则阳极反应式为:
。
④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式: 。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)  2H2(g)+O2(g)
△H=+484 kJ·mol-1
2H2(g)+O2(g)
△H=+484 kJ·mol-1
T1温度下不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
1.0 |
1.6 |
2.0 |
2.0 |
前20 min的反应速率 v(H2O)= ;该该温度下,反应的平衡常数的表达式K= ;若T2温度下K=0.4,T1 T2(填>、<、=)
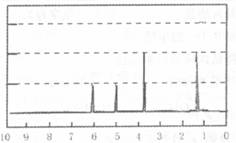
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;

③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。

A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
查看习题详情和答案>>
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g)
 N2(g)+2H2O(l) △H="-a" kJ/mol
N2(g)+2H2O(l) △H="-a" kJ/molCu(OH)2(s)
 CuO(s)+H2O(l) △H="b" kJ/mol
CuO(s)+H2O(l) △H="b" kJ/mol4CuO(s)
 2Cu2O(s)+O2(g) △H="c" kJ/mol
2Cu2O(s)+O2(g) △H="c" kJ/mol则该方法制备Cu2O的热化学方程式为 。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O
 Cu2O+H2↑,则阳极反应式为: 。
Cu2O+H2↑,则阳极反应式为: 。④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式: 。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)
 2H2(g)+O2(g) △H=+484 kJ·mol-1
2H2(g)+O2(g) △H=+484 kJ·mol-1T1温度下不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;

③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。

A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
| 实验步骤 | 实验结论 |
| (1)称取A 4.5g,加热使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为 90 90 |
| (2)将此4.5gA在足量O2中充分燃烧,并使其产物依次缓缓通过盛有足量浓硫酸、氢氧化钠溶液的洗气瓶,发现两者分别增重2.7g和6.6g. | (2)A的分子式为 C3H6O3 C3H6O3 |
| (3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12L CO2,若与足量金属钠反应则生成1.12LH2(气体体积均在标准状况下测定). | (3)用结构简式表示A中含有的官能团: -OH -OH 、-COOH -COOH . |
(4)A的核磁共振氢谱如图: |
(4)A的结构简式为:   |
(11分)
有机物A仅含有C、H、O三种元素,常温下为无色粘稠液体,易溶于水。为研究A的组成与结构,化学研究性学习小组进行了如下实验:
| 实验步骤 | 实验结论 |
| (1)称取A 4.5kg,加热使其汽化,测其密度是相同条件下H2的45倍。 | (1)A的相对分子质量为 90 |
| (2)将此4.5gA在足量O2中充分燃烧,并使其产物依次缓缓通过盛有足量浓硫酸、氢氧化钠溶液的洗气瓶,发现两者分别增重2.7g和6.6g。 | (2)A的分子式为 |
| (3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2,若与足量金属钠反应则生成1.12LH2(气体体积均在标准状况下测定)。 | (3)用结构简式表示A中含有的官能团:
|
| (4)A的1H核磁共振氢谱如下图:
| (4)A的结构简式为 |
(12分)纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:
![]() ① 在潮湿空气中CaO2能够发生反应:
① 在潮湿空气中CaO2能够发生反应:
CaO2+2H2O → Ca(OH)2+H2O2 2CaO2+2CO2 → 2CaCO3+O2
![]() ② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
![]() 在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2。CaO2?8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
在实验室可用钙盐制取CaO2?8H2O,再经脱水制得CaO2。CaO2?8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
![]() 其制备过程如下:
其制备过程如下:

根据以上信息,回答下列问题:w.w.w.k.s.5.u.c.
(1)用上述方法制取CaO2?8H2O的化学方程式是 ;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 ;
(3)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
(4)为了检验“水洗”是否合格的方法是
![]()
(5)测定产品中CaO2的含量的实验步骤是:
![]() 第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶
液,充分反应。
![]()
第二步:向上述锥形瓶中加入几滴淀粉溶液。
![]()
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
![]() 【已知:I2+2S2O32-= 2I-+S4O62-(无色)】
【已知:I2+2S2O32-= 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是 ;
![]()
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是
查看习题详情和答案>>