网址:http://m.1010jiajiao.com/timu3_id_154536[举报]
铝及铝合金经过阳极氧化,铝表面能生成几十微米的较厚的氧化铝膜。

Ⅰ.某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面;
b.用水冲洗经有机物擦洗的铝片,浸入60~70 ℃的2 mol·L-1的NaOH溶液中,以除去原有的氧化膜,约1 min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解;
c.阳极氧化,以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。
试回答下列问题:
(1)用苯和酒精擦拭铝片的目的:_______________________________,
氢氧化钠溶液处理铝片时反应的离子方程式是____________________________________。
(2)阳极的电极反应式为______________________________。
(3)下列有关说法正确的是________(填字母代号)。
A.电解时电子从电源负极→导线→铅极,铝极→导线→电源正极
B.在电解过程中,H+向阳极移动,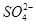 向阴极移动
向阴极移动
C.电解过程中溶液的pH基本不变
D.电解时,铝片为阳极,被氧化
Ⅱ.另一小组针对铝表面保护膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期用来盛放和腌制咸菜。究其原因,该小组设计了一个实验以探究其中的原因。他们的实验过程如下:
|
实验 |
|
|
|
编号 |
实验过程 |
实验现象 |
|
1 |
取一小片铝片于试管中,加入1.0 mol·L-1的盐酸2 mL |
30秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
2 |
取一小片铝片于试管中,加入0.5 mol·L-1的硫酸2 mL |
55秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
3 |
取一小片铝片于试管中,加入氯化铜稀溶液 |
3分钟左右表面产生少量气泡,且铝表面析出一些红色固体 |
|
4 |
取一小片铝片于试管中,加入硫酸铜稀溶液 |
一直没有明显的变化 |
你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是________________________________________________________________________。
根据该实验现象,你认为铝制容器不能长期盛放和腌制咸菜的原因是________________________________________________________________________。
查看习题详情和答案>>
(1)属于强电解质且在上述状态下能导电的是_____________________;
(2)属于弱电解质的是_____________________________;
(3)属于非电解质,但溶于水后的水溶液能导电的是________________________。
(4)在同体积、同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________;
(5)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________;
(6)物质的量浓度均为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是___________。
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程。
(一)结构分析
(1)写出乙醇的结构式 ;官能团的电子式 。
(二)性质预测
(2)对比乙醇和乙烷的结构,经过讨论,同学们认为乙醇分子中氧原子吸引电子能力较强,预测在一定条件下分子中 键(填写具体共价键)容易发生断裂。为此,他们查阅了相关资料,获得了以下乙醇性质的部分事实。
|
下列关于乙醇结构和性质的分析、理解错误的是
A.-OH对-C2H5的影响使乙醇与钠的反应比水与钠的反应速率慢ks5u
B. 乙醇在浓硫酸催化下,170℃时脱水生成乙烯的反应为消去反应
C. 乙醇的核磁共振氢谱图上有3个吸收峰,其强度之比为3︰2︰1,与钠反应的是
吸收强度最小的氢原子
 D. 乙醇与甲醚互为官能团异构体
D. 乙醇与甲醚互为官能团异构体
(三)设计方案、进行实验
甲同学用4mL 95%的乙醇、8mL90%浓硫酸、
6g溴化钠研究乙醇转化为溴乙烷的反应。右图
是他设计的实验装置图(已省略部分夹持仪器)。
请回答有关问题。
(3)预计实验时装置Ⅰ主要发生两个反应,写出反应②的化学方程式。
![]() ①2NaBr + H2SO4 2HBr + Na2SO4,
①2NaBr + H2SO4 2HBr + Na2SO4,
②
(4)实验过程中,观察到反应后期烧瓶内液体颜色变棕黑,U形管右边与大气相通的导管口产生大量有刺激性气味的白雾,U形管内有少量淡黄色液体,该液体的有机成分是 。若要获得纯净的溴乙烷,方法是:实验结束后 。
(四)反思与改进
(5)乙同学认为:实验所用浓硫酸必须进行稀释,目的是 (填字母),稀释后的浓硫酸应放在 (填实验仪器名称)中。
A.减少HBr的挥发 B.防止浓硫酸分解产生SO2
C.减少副产物乙烯和乙醚的生成 D.减少Br2的生成
(6)丙同学提出应该对实验装置进行改进,请为两部分装置选择正确的措施:
A.不作改变 B.保留酒精灯加热,增加温度计且温度计水银球插入反应液中
C.水浴加热 D.冰水混合物冷却
装置Ⅰ ;装置Ⅱ 。请你再提出一条改进措施 。
查看习题详情和答案>>(17分)Ⅰ:现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、 ⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3。请用物质的序号填写下列空白
(1)属于强电解质的有: 。
(2)液态时能导电且为物理变化的有: 。
(3)⑦在水溶液的电离方程式为 。
Ⅱ:A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。处理C物质可得到有价值的化学品,写出该化学品中的1种酸和1种盐的名称 、 。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是___ _____。写④反应离子方程 。
(4)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。