摘要:通SO2的品红27.略 28.Na2SO4为1.42g.在.碳酸氢钠1.68g.碳酸钠为7.42g
网址:http://m.1010jiajiao.com/timu3_id_154343[举报]
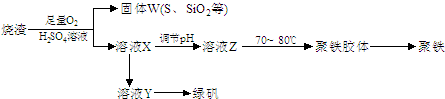
(2010?山东)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4?7H2O )过程如下:

(1)验证固体W焙烧后产生的气体含有SO2 的方法是
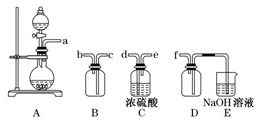
(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
查看习题详情和答案>>

(1)验证固体W焙烧后产生的气体含有SO2 的方法是
将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.证明有该气体.
将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.证明有该气体.
.(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
d
d
→e
e
→c
c
→b
b
→f装置D的作用是安全瓶,防止倒吸
安全瓶,防止倒吸
,装置E中NaOH溶液的作用是尾气处理,防止污染
尾气处理,防止污染
.
(3)制备绿矾时,向溶液X中加入过量
铁粉
铁粉
,充分反应后,经过滤
过滤
操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾.(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
将试纸放到表面皿上,用洁净的玻璃棒蘸取少许待测液,滴在试纸的中央.然后与标准比色卡对比.
将试纸放到表面皿上,用洁净的玻璃棒蘸取少许待测液,滴在试纸的中央.然后与标准比色卡对比.
.若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏偏低
偏低
.(2011?南开区一模)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4?7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是:
(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
装置A中发生反应的化学方程式为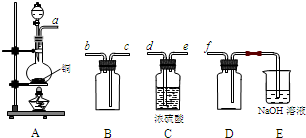
装置D的作用是
(3)制备绿矾时,向溶液X中加入过量
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,定容时视线应
(5)溶液Z的pH影响聚铁中铁的质量分数.若溶液Z的pH偏小,将导致聚铁中铁的质量分数
查看习题详情和答案>>

(1)验证固体W焙烧后产生的气体含有SO2的方法是:
将其气体通入品红试液,溶液褪色,加热恢复红色,证明有二氧化硫
将其气体通入品红试液,溶液褪色,加热恢复红色,证明有二氧化硫
.(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
d
d
→e
e
→c
c
→b
b
→f.装置A中发生反应的化学方程式为
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||

装置D的作用是
安全瓶、防止倒吸
安全瓶、防止倒吸
,装置E中NaOH溶液的作用是吸收多余的二氧化硫
吸收多余的二氧化硫
.(3)制备绿矾时,向溶液X中加入过量
铁屑
铁屑
,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾.过滤所需的玻璃仪器有烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,定容时视线应
平视刻度线
平视刻度线
,直到凹液面最低处和刻度相切
凹液面最低处和刻度相切
.用KMnO4标准溶液滴定时应选用酸式
酸式
滴定管(填“酸式”或“碱式”).(5)溶液Z的pH影响聚铁中铁的质量分数.若溶液Z的pH偏小,将导致聚铁中铁的质量分数
偏小
偏小
(填“偏大”、“偏小”或“无影响”).
某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:
实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体.
(1)该小组作出此推测的理由是: .
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2mol/L的H2C2O4标准溶液、0.1mol/L的酸性KMnO4标准溶液、酸碱指示剂.
b.实验装置设计及组装(加热及夹持装置均已略去)
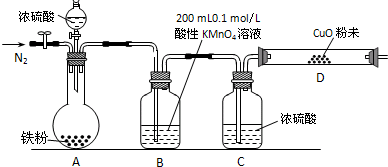
【实验过程及数据处理】
(2)B中发生反应的离子方程式为: .
(3)实验前先通入一段时间的N2,其目的是 .
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是
.
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25mL,用H2C2O4标准溶液进行滴定.
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平.
H2C2O4+ MnO4-+ H+= Mn2++ H2O+
②滴定达到终点时的现象是 .
③重复滴定两次,平均每次耗用H2C2O4标准溶液15.63mL,则铁与浓硫酸反应产生的SO2气体
的物质的量为 ;经称量,实验前后装置D的质量减少0.8g,则产生的气体中SO2的体积分数为 .
查看习题详情和答案>>
实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体.
(1)该小组作出此推测的理由是:
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2mol/L的H2C2O4标准溶液、0.1mol/L的酸性KMnO4标准溶液、酸碱指示剂.
b.实验装置设计及组装(加热及夹持装置均已略去)

【实验过程及数据处理】
(2)B中发生反应的离子方程式为:
(3)实验前先通入一段时间的N2,其目的是
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25mL,用H2C2O4标准溶液进行滴定.
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平.
②滴定达到终点时的现象是
③重复滴定两次,平均每次耗用H2C2O4标准溶液15.63mL,则铁与浓硫酸反应产生的SO2气体
的物质的量为
(2009?江门一模)实验室制备纯碱的主要步骤是:
①将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体
②加料完毕后,继续保温30分钟
③静置、过滤得NaHCO3晶体
④用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧,制得Na2CO3固体.
四种盐在不回温度下的溶解度(g/l00g水)表
①>35℃NH4HC03会有分解
请回答:
(1)反应温度控制在30-35℃,是因为
(2)加料完毕后,继续保温30分钟,目的是
(3)洗涤NaHCO3晶体的操作是
(4)过滤所得的母液中含有的溶质
(5)写出本实验中制备纯碱的有关化学方程式
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c (mol/L)的HCl溶液滴定至溶液由红色到无色,所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:
×100%
×100%.
查看习题详情和答案>>
①将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体
②加料完毕后,继续保温30分钟
③静置、过滤得NaHCO3晶体
④用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧,制得Na2CO3固体.
四种盐在不回温度下的溶解度(g/l00g水)表
 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
请回答:
(1)反应温度控制在30-35℃,是因为
温度高于35℃NH4HCO3分解,温度低于30℃反应速率降低
温度高于35℃NH4HCO3分解,温度低于30℃反应速率降低
;为控制此温度范围,采取的加热方法为水浴加热
水浴加热
.(2)加料完毕后,继续保温30分钟,目的是
使反应充分反应
使反应充分反应
;静置后只析出NaHCO3品体的原因是碳酸氢钠溶解度最小
碳酸氢钠溶解度最小
.(3)洗涤NaHCO3晶体的操作是
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置待蒸馏水滤出,重复操作2-3次
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置待蒸馏水滤出,重复操作2-3次
.(4)过滤所得的母液中含有的溶质
NH4Cl NaCl NH4HCO3 NaHCO3
NH4Cl NaCl NH4HCO3 NaHCO3
(以化学式表示).(5)写出本实验中制备纯碱的有关化学方程式
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
.(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c (mol/L)的HCl溶液滴定至溶液由红色到无色,所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:
| c(v2-v1)106 |
| 1000w |
| c(v2-v1)106 |
| 1000w |