题目内容
某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体.
(1)该小组作出此推测的理由是:
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2mol/L的H2C2O4标准溶液、0.1mol/L的酸性KMnO4标准溶液、酸碱指示剂.
b.实验装置设计及组装(加热及夹持装置均已略去)
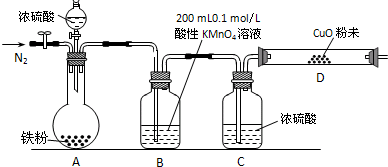
【实验过程及数据处理】
(2)B中发生反应的离子方程式为:
(3)实验前先通入一段时间的N2,其目的是
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25mL,用H2C2O4标准溶液进行滴定.
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平.
②滴定达到终点时的现象是
③重复滴定两次,平均每次耗用H2C2O4标准溶液15.63mL,则铁与浓硫酸反应产生的SO2气体
的物质的量为
分析:(1)根据加热时铁与浓硫酸反应生成二氧化硫,浓硫酸变成稀硫酸,铁与稀硫酸反应生成氢气;
(2)二氧化硫具有还原性,能够与酸性高锰酸钾溶液发生氧化还原反应;
(3)通入氮气可以将装置中的空气排出,避免氢气与空气中的氧气发生爆炸;
(4)根据装置B中酸性高锰酸钾溶液溶液颜色变浅证明含有二氧化硫,根据装置D中黑色的氧化铜变成红色证明混合气体中含有氢气;
(5)①根据氧化还原反应中化合价升降相等配平该反应的离子方程式;
②根据滴定前溶液为紫红色,滴定结束时溶液紫红色褪去判断滴定终点;
③根据滴定数据计算出二氧化硫消耗的高锰酸根离子的物质的量,再根据反应方程式计算出二氧化硫的物质的量;根据装置D减少的质量为O元素计算出混合气体中氢气的物质的量,再计算出二氧化硫的体积分数.
(2)二氧化硫具有还原性,能够与酸性高锰酸钾溶液发生氧化还原反应;
(3)通入氮气可以将装置中的空气排出,避免氢气与空气中的氧气发生爆炸;
(4)根据装置B中酸性高锰酸钾溶液溶液颜色变浅证明含有二氧化硫,根据装置D中黑色的氧化铜变成红色证明混合气体中含有氢气;
(5)①根据氧化还原反应中化合价升降相等配平该反应的离子方程式;
②根据滴定前溶液为紫红色,滴定结束时溶液紫红色褪去判断滴定终点;
③根据滴定数据计算出二氧化硫消耗的高锰酸根离子的物质的量,再根据反应方程式计算出二氧化硫的物质的量;根据装置D减少的质量为O元素计算出混合气体中氢气的物质的量,再计算出二氧化硫的体积分数.
解答:解:(1)由于在加热的条件下浓硫酸与Fe反应生成SO2,随着反应的进行,硫酸浓度变稀,稀硫酸与Fe反应生成H2,
故答案为:在加热的条件下浓硫酸与Fe反应生成SO2,随着反应的进行,硫酸浓度变稀,与Fe反应生成H2;
(2)二氧化硫与酸性高锰酸钾溶液溶液反应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(3)氢气能够与氧气反应发生爆炸,所以反应前需要排除装置中的空气,防止H2与空气混合受热发生爆炸,
故答案为:排除装置中的空气,防止H2与空气混合受热发生爆炸;
(4)二氧化硫具有还原性,能够与酸性高锰酸钾溶液反应,若装置B中酸性高锰酸钾溶液紫红色变浅说明生成了SO2,氢气具有还原性,能够使黑色的氧化铜还原成红色的铜,所以D中黑色粉末变红说明生成了H2 ,
故答案为:B瓶中溶液紫红色变浅说明生成了SO2;装置D中黑色粉末变红说明生成了H2 ;
(5)①H2C2O4+MnO4-+H+-Mn2++H2O+,高锰酸根离子中Mn元素化合价由+7变为+2,化合价降低了5价,反应中高锰酸根离子被还原,则草酸中的C在反应中被氧化,草酸中C的化合价为+3价,只能被氧化成二氧化碳气体,所以未知物为二氧化碳,草酸被氧化成二氧化碳,化合价升高至少升高(4-3)×2=2价,化合价变化的最小公倍数为10,则高锰酸根离子化学计量数为2,草酸的计量数为5,然后利用电荷守恒及观察法配平其它物质,配平后的反应方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2,
故答案为:5;2;6;2;8;10CO2;
②滴定结束前溶液为紫红色,滴定结束后溶液紫红色褪去,所以滴定终点现象为:滴入最后一滴H2C2O4溶液时KMnO4溶液的紫红色褪去且半分钟之内不恢复,
故答案为:滴入最后一滴H2C2O4溶液时KMnO4溶液的紫红色褪去且半分钟之内不恢复;
③草酸的物质的量为:0.2mol/L×0.01563L=0.003126mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2,草酸消耗的高锰酸根离子的物质的量为:0.003216mol×
≈0.00125mol,25mL反应后的溶液中高锰酸根离子减少的物质的量为:0.1mol/L×0.0025L-0.0125mol=0.00125mol,则二氧化硫总的消耗的高锰酸根离子的物质的量为:0.00125mol×
=0.01mol,根据反应5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,反应生成的二氧化硫的物质的量为:0.01mol×
=0.025mol;
装置D的质量减少0.8g,氧化铁与氢气反应,减少的质量为O的质量,与氢气反应的O的物质的量为:
=0.05mol,根据反应的关系式CuO~H2可知,氢气的物质的量也为0.05mol,所以混合气体中二氧化硫的体积分数为:
×100%=33.3%,
故答案为:0.025 mol;33.3%.
故答案为:在加热的条件下浓硫酸与Fe反应生成SO2,随着反应的进行,硫酸浓度变稀,与Fe反应生成H2;
(2)二氧化硫与酸性高锰酸钾溶液溶液反应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(3)氢气能够与氧气反应发生爆炸,所以反应前需要排除装置中的空气,防止H2与空气混合受热发生爆炸,
故答案为:排除装置中的空气,防止H2与空气混合受热发生爆炸;
(4)二氧化硫具有还原性,能够与酸性高锰酸钾溶液反应,若装置B中酸性高锰酸钾溶液紫红色变浅说明生成了SO2,氢气具有还原性,能够使黑色的氧化铜还原成红色的铜,所以D中黑色粉末变红说明生成了H2 ,
故答案为:B瓶中溶液紫红色变浅说明生成了SO2;装置D中黑色粉末变红说明生成了H2 ;
(5)①H2C2O4+MnO4-+H+-Mn2++H2O+,高锰酸根离子中Mn元素化合价由+7变为+2,化合价降低了5价,反应中高锰酸根离子被还原,则草酸中的C在反应中被氧化,草酸中C的化合价为+3价,只能被氧化成二氧化碳气体,所以未知物为二氧化碳,草酸被氧化成二氧化碳,化合价升高至少升高(4-3)×2=2价,化合价变化的最小公倍数为10,则高锰酸根离子化学计量数为2,草酸的计量数为5,然后利用电荷守恒及观察法配平其它物质,配平后的反应方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2,
故答案为:5;2;6;2;8;10CO2;
②滴定结束前溶液为紫红色,滴定结束后溶液紫红色褪去,所以滴定终点现象为:滴入最后一滴H2C2O4溶液时KMnO4溶液的紫红色褪去且半分钟之内不恢复,
故答案为:滴入最后一滴H2C2O4溶液时KMnO4溶液的紫红色褪去且半分钟之内不恢复;
③草酸的物质的量为:0.2mol/L×0.01563L=0.003126mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2,草酸消耗的高锰酸根离子的物质的量为:0.003216mol×
| 2 |
| 5 |
| 200mL |
| 25mL |
| 5 |
| 2 |
装置D的质量减少0.8g,氧化铁与氢气反应,减少的质量为O的质量,与氢气反应的O的物质的量为:
| 0.8g |
| 16g/mol |
| 0.025mol |
| 0.025mol+0.05mol |
故答案为:0.025 mol;33.3%.
点评:本题考查浓硫酸的性质、氧化还原反应的配平、中和滴定及化学计算,题目难度较大,注意掌握浓硫酸与铜、铁在加热条件下反应原理,能够根据氧化还原反应中化合价升降相等配平方程式,(5)为难点和易错点,注意明确反应原理及计算方法.

练习册系列答案
相关题目
某研究性学习小组根据侯德榜制碱法原理并参考下表有关物质溶解度(g/100g水)数据,以饱和NaCl溶液与研细的NH4HCO3为原料,设计实验经两步反应制备纯碱.
下列有关说法中,正确的是( )
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反应的基本类型为化合反应、分解反应 |
| B、第一、二步反应之间的主要实验操作是过滤、洗涤 |
| C、第一步反应控制温度高于30℃目的是提高反应产率 |
| D、反应液加盐酸处理可使NaCl循环使用并回收NH4Cl |
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.