网址:http://m.1010jiajiao.com/timu3_id_153898[举报]
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序?????? 。
(2)下列说法错误的是??????? 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物???????? (高或低),
原因是?????????? 。
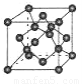
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为??????? cm。

(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为________ __。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为??????? (用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有?????? 。

查看习题详情和答案>>
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序?????? 。
(2)下列说法错误的是??????? 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物???????? (高或低),原因是?????????? 。
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为??????? cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为____ 。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成【F(N)4】2+,该离子的结构式为??????? (用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有?????? 。

查看习题详情和答案>>
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序 。
(2)下列说法错误的是 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物 (高或低),原因是 。
(4)B单质的一种同素异形体的晶胞如图甲所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为 cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
① F原子的外围电子排布式为________。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为 。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图乙所示的离子:该离子中碳原子的杂化方式有 。


图甲 图乙
依照阿伏加德罗定律,下列叙述正确的是
( ) A.同温同压下两种气体的体积之比等于摩尔质量之比。
B.同温同压下两种气体的物质的量之比等于密度之比。 C.同温同压下两种气体的摩尔质量之比等于密度之比。D.同温同体积下两种气体的物质的量之比等于压强之比。
设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A. 醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等。
B.标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2 NA。
C.1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA。
D.25℃,1.01×105Pa时,16g臭氧所含的原子数为NA。
设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA。
B.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L。
C. 在常温常压下,6g石英晶体中,含有0.4NA个硅氧共价键。
D.120g由NaHSO4和KHSO3组成的混合物中含有硫原子NA个。
标准状况下,下列混合气体的平均式量可能是50的是 ( )
A.硫化氢和二氧化硫 B.一氧化氮和氧气
C.二氧化硫和溴化氢 D.碘化氢和氯气
在一个恒容密闭容器中充入11gX气体(摩尔质量为 44g·mol-1),压强为1×105pa。如果保持温度不变,继续充入X气体,使容器内压强达到5×105pa。则此时容器内的气体X的分子数约为 ( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为 ( )
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
同温、同压下,CO2 和NO的混合气体 20mL,通过足量过氧化钠后气体体积减少到10mL,则原混合气体的体积比可能是 ( )
A.1∶1 B.2∶3 C.3∶2 D.1∶4
乙炔和乙烯的混合气体完全燃烧时,所需氧气的体积是原混合气体的2.7倍,则该混合气体与足量的H2发生加成反应时,消耗H2的体积是原混合气体体积的 ( ) A.1.6倍 B.1.8倍 C.1.4倍 D.1.2倍
在一定条件下,将5体积NO、5体积NO2、6体积O2混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积是 ( )
A.1体积 B.2体积 C.3体积 4.4体积
19世纪,化学家对氧化锆的化学式有争议.经测定锆的相对原子质量为91,其氯化物蒸气的密度是同溶、同压下H2密度的116-117倍,试判断与氯化物价态相同的氧化锆的化学式 ( )
A.ZrO B.Zr2O C.Zr2O3 D.ZrO2
常温下,向20L真空容器中通入A mol硫化氢和 Bmol氯气(A,B均为不超过5的正整数),反应完全后,容器内气体可能达到的最大密度是 ( )
A.8.5 g·L-1 B.18.25g·L-1 C.18.5 g·L-1 D.35.5 g· L-1
查看习题详情和答案>>