题目内容
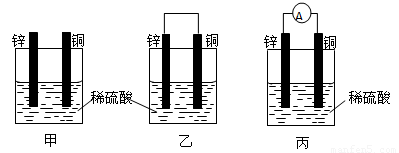
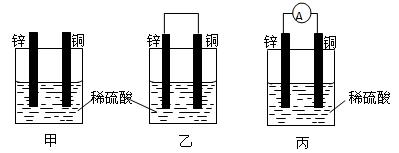
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上

(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过.图乙、图丙是一个将
(3)从上述现象中可以归纳出构成原电池的一些条件是
没有
没有
(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上有
有
(填“有”或“没有”)气泡产生.
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过.图乙、图丙是一个将
化学
化学
能转化为电
电
能的装置,人们把它叫做原电池.(3)从上述现象中可以归纳出构成原电池的一些条件是
两电极要插入电解质溶液,并用导线连接形成回路
两电极要插入电解质溶液,并用导线连接形成回路
,有关的电极反应式:锌片Zn-2e-=Zn2+
Zn-2e-=Zn2+
;铜片2H++2e-=H2↑
2H++2e-=H2↑
.分析:(1)金属铜不能和酸反应置换出氢气,在原电池中,产生气泡的极只能是正极;
(2)原电池是将化学能转化为电能的装置;
(3)构成原电池的条件:有活泼性不同的两个电极;有电解质溶液;形成闭合回路;原电池的正极发生得电子得还原反应,负极发生失电子的氧化反应.
(2)原电池是将化学能转化为电能的装置;
(3)构成原电池的条件:有活泼性不同的两个电极;有电解质溶液;形成闭合回路;原电池的正极发生得电子得还原反应,负极发生失电子的氧化反应.
解答:解:(1)将铜插到硫酸中,金属铜不能和酸反应置换出氢气,再用导线把锌片和铜片连接起来,会形成Zn、Cu、硫酸原电池,在正极上氢离子得电子产生氢气,
故答案为:没有;有;
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连,即形成了原电池,原电池是将化学能转化为电能的装置,故答案为:化学;电能;
(3)构成原电池的条件:有活泼性不同的两个电极;有电解质溶液;形成闭合回路,Zn、Cu、硫酸原电池中,活泼金属锌做负极,电极反应为:Zn-2e-=Zn2+,金属铜做正极,电极反应为:2H++2e-=H2↑,故答案为:两电极要插入电解质溶液,并用导线连接形成回路;Zn-2e-=Zn2+;2H++2e-=H2↑.
故答案为:没有;有;
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连,即形成了原电池,原电池是将化学能转化为电能的装置,故答案为:化学;电能;
(3)构成原电池的条件:有活泼性不同的两个电极;有电解质溶液;形成闭合回路,Zn、Cu、硫酸原电池中,活泼金属锌做负极,电极反应为:Zn-2e-=Zn2+,金属铜做正极,电极反应为:2H++2e-=H2↑,故答案为:两电极要插入电解质溶液,并用导线连接形成回路;Zn-2e-=Zn2+;2H++2e-=H2↑.
点评:本题考查原电池的概念和工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 人们把它叫做原电池。
人们把它叫做原电池。