摘要:向100mL2mol/L的AlCl3溶液中加入1mol/L的NaOH溶液得到沉淀3.9g.则加入的NaOH溶液的体积应为多少mL?
网址:http://m.1010jiajiao.com/timu3_id_153381[举报]
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是
水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶)
水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶)
,反应的离子方程式是2OH-+CO2=CO32-+H2O(或OH-+CO2=HCO3-)
2OH-+CO2=CO32-+H2O(或OH-+CO2=HCO3-)
.(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液在一定条件下蒸发结晶,得到少量的白色固体.试设计实验确认该白色固体的成分.
①提出合理假设.
假设1:该白色固体为NaOH和Na2CO3;
假设2:该白色固体为只有Na2CO3;
假设3:该白色固体为只有NaHCO3;
假设4:该白色固体为
Na2CO3和NaHCO3
Na2CO3和NaHCO3
.②基于假设1,设计实验方案进行实验证明固体的成分是NaOH和Na2CO3.请在答题卡上写出实验步骤及预期现象和结论.(步骤可不填满也可增加)
限选实验试剂及仪器:1moL?L-1HCl溶液、1mol?L-1 MgCl2溶液、0.5moL?L-1BaCl2溶液、1mol?L-1 Ba(OH)2溶液、甲基橙试液、酚酞试液、试管、胶头滴管、过滤装置.
| 实验步骤 | 预期现象和结论 |
| 步骤1: 取少量白色固体于试管中,加适量水溶解,再加0.5moL?L-1BaCl2溶液至过量 取少量白色固体于试管中,加适量水溶解,再加0.5moL?L-1BaCl2溶液至过量 |
产生白色沉淀,说明固体中含有Na2CO3 产生白色沉淀,说明固体中含有Na2CO3 |
| 步骤2: 过滤,取少量滤液(或:静置,用胶头滴管取上层清液少许)于试管中,再向试管中滴加1~2滴酚酞试液 过滤,取少量滤液(或:静置,用胶头滴管取上层清液少许)于试管中,再向试管中滴加1~2滴酚酞试液 |
溶液变红色,说明固体中含有NaOH 溶液变红色,说明固体中含有NaOH |
| 步骤3: 无 无 |
无 无 |
 Ⅰ.纯碱、烧碱等是重要的化工原料.
Ⅰ.纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是
(2)向100mL2mol/L的NaOH溶液中通入一定量CO2,结晶,得到NaOH和Na2CO3的混合物9.3g,其中Na2CO3 的质量为
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 | ||
| ②过滤,取2mL滤液于试管中, |
原白色固体中有OH-存在 |
(1)现有标准状况下8.96LSO2和24gO3,则相同状况下SO2与O3的体积之比为
(2)向100mL2mol/L的NaOH溶液中缓慢通入一定量的CO2.
①当n(CO2)≤0.1mol 时,反应的离子方程式为:
②当0.1mol<n(CO2)<0.2mol时,所得溶液的溶质有
查看习题详情和答案>>
4:5
4:5
,所含氧原子数之比为8:15
8:15
.(2)向100mL2mol/L的NaOH溶液中缓慢通入一定量的CO2.
①当n(CO2)≤0.1mol 时,反应的离子方程式为:
CO2+2OH-=CO32-
CO2+2OH-=CO32-
;②当0.1mol<n(CO2)<0.2mol时,所得溶液的溶质有
Na2CO3、NaHCO3
Na2CO3、NaHCO3
.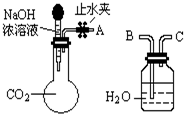 如图装置可证明CO2与NaOH溶液发生了反应:
如图装置可证明CO2与NaOH溶液发生了反应:(1)将A与B连接,打开止水夹将胶头滴管中的液体挤入烧瓶,此时的现象是
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该固体的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3;
假设2:该固体只有Na2CO3;
假设3:该固体只有
假设4:该固体为
②.请设计实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的现象和结论.(步骤可不填满也可增加)
限选的试剂、仪器:1moL?L-1HCl、1mol?L-1 MgCl2、0.5moL?L-1BaCl2和1mol?L-1 Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置.
| 实验步骤 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
向氢氧化钠溶液中慢慢地通入二氧化硫气体,反应生成正盐,当继续通入过量二氧化硫时,正盐便转化成酸式盐.
(1)写出上述反应的化学方程式
①
②
(2)标准状态下,向100mL2mol/L的NaOH溶液中通入3.36L二氧化硫气体,反应后溶液中溶质的成分为
(3)试计算,在标准状态下,100mL2mol/L的NaOH溶液中最多可吸收多少体积二氧化硫气体?
查看习题详情和答案>>
(1)写出上述反应的化学方程式
①
SO2+2NaOH=Na2SO3+H2O
SO2+2NaOH=Na2SO3+H2O
②
Na2SO3+SO2+H2O=2NaHSO3
Na2SO3+SO2+H2O=2NaHSO3
(2)标准状态下,向100mL2mol/L的NaOH溶液中通入3.36L二氧化硫气体,反应后溶液中溶质的成分为
Na2SO3、NaHSO3
Na2SO3、NaHSO3
.(3)试计算,在标准状态下,100mL2mol/L的NaOH溶液中最多可吸收多少体积二氧化硫气体?
4.48L
4.48L
.