网址:http://m.1010jiajiao.com/timu3_id_153016[举报]
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)
4R(s)+2Z3(g)
则16g Z2(g)完全转化为Z3(g)的△H= . 查看习题详情和答案>>
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
|
元素 |
相关信息 |
|
T |
T原子所处的周期数、族序数分别与其原子序数相等 |
|
X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
|
Z |
Z的基态原子价电子排布为 |
|
Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
|
R |
3p能级上有1个电子 |
|
W |
W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .
查看习题详情和答案>>
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为
(填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .
查看习题详情和答案>>| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为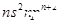 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)
4R(s)+2Z3(g)
则16g Z2(g)完全转化为Z3(g)的△H= .
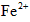 34%~36%,是糖衣片,……,与
34%~36%,是糖衣片,……,与 (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:(1)第一步:查阅资料得知,双氧水可以氧化
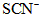 生成
生成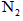 、
、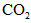 和SO42-,也可以将
和SO42-,也可以将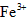 氧化成
氧化成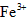 。
。(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有Fe2+离子存在;
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量
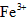 离子存在。该离子存在的原因可能是(填序号):___________________
离子存在。该离子存在的原因可能是(填序号):___________________ ①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成。
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的
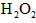 溶液,溶液的红色先变深,之后红色逐渐褪去。
溶液,溶液的红色先变深,之后红色逐渐褪去。 ①红色变深的原因是(用离子方程式表示):__________________________;
②请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:____________________。
(6)第六步:向B试管的溶液中加入一片
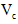 片,片刻后溶液红色也褪去,说明
片,片刻后溶液红色也褪去,说明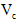 有___________性。
有___________性。II、以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S,CuFeS2+4Fe3+=Cu2++5Fe2++2S, 2Fe3+ + H2S = 2H+ + S↓ + 2Fe2+。下图为该工艺的示意图。
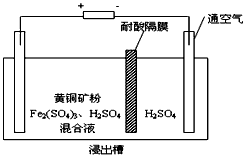
(2)电解过程中阴极有金属析出,向阴极通空气的原因是________________________。
(3)与燃烧法炼铜相比,电解法的优点为________________________。
