网址:http://m.1010jiajiao.com/timu3_id_152373[举报]
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过
程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.甲、乙分别是实验室模拟合成氨及氨催化氧化的装置
 |
⑴ 氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有控制气体流速、 ▲ 。
⑵ 用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,铂丝保
持红热的原因是 ▲ ,写出乙装置中氨氧化的化学方程式 ▲ 。反应结束后锥形瓶内的溶
液中含有H+、OH-、 ▲ 、 ▲ 离子。
II.工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
⑴ 工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
⑵ 尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= ▲ (空气中氧气的体积含量约为20%)。
查看习题详情和答案>>硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.图10、图11分别是实验室模拟合成氨及氨催化氧化的装置
(1)氮气和氢气通过图10装置,该装置中浓硫酸的作用是控制气体流速和 。
(2)用图11装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是 ,写出该装置中氨氧化的化学方程式 。反应结束后锥形瓶内的溶液中含有H+、OH-、 离子、 离子。
II.下列有关硝酸事实的解释合理的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子 |
| C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化 |
(1)工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为 。
(2)尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=3∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量约为20%)。 查看习题详情和答案>>
I.图10、图11分别是实验室模拟合成氨及氨催化氧化的装置
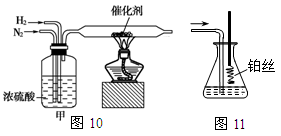
(1)氮气和氢气通过图10装置,该装置中浓硫酸的作用是控制气体流速和 。
(2)用图11装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是 ,写出该装置中氨氧化的化学方程式 。反应结束后锥形瓶内的溶液中含有H+、OH-、 离子、 离子。
II.下列有关硝酸事实的解释合理的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子 |
| C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化 |
(1)工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为 。
(2)尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=3∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量约为20%)。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式???????????????????? 。
已知:? ① CO(g)+H2O(g) H2(g)+CO2(g)??? ΔH=-41kJ·mol-1
H2(g)+CO2(g)??? ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g)??????????? ΔH=-73kJ·mol-1
CH4(g)??????????? ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g)???? ????? ΔH=-171kJ·mol-1
C(s)+CO2(g)???? ????? ΔH=-171kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。

②某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是??? ? ??? ?? ;

A. P3>P2,T3>T2???????? B. P1>P3,T1>T3??? C. P2>P4,T4>T2???????? D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ????? ;
A. 正反应速率先增大后减小
B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大
D. 反应物的体积百分含量增大
E. 混合气体的密度减小
F. 氢气的转化率减小
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式__?????????????????????????? ?? 。以此燃料电池作为外接电源按图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是????????????????????? ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入?????? (填物质名称),其质量约为??? g。

查看习题详情和答案>>
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。
②某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
A. 正反应速率先增大后减小
B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大
D. 反应物的体积百分含量增大
E. 混合气体的密度减小
F. 氢气的转化率减小
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式__ 。以此燃料电池作为外接电源按图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。