摘要:21.硒是一种保健元素.工业上从含硒的废料中提取硒的方法之一是用硫酸与硝酸处理废料.获得亚硝酸和少量硒酸.再与盐酸共热.硒酸转化为亚硒酸.化学反应方程式为:2HCl+H2SeO4=H2SeO3+Cl2↑+H2O.向亚硒酸溶液中通入SO2.即析出单质硒. (1)比较:硒酸和硝酸的氧化性强弱 ,亚硒酸和盐酸的还原性强弱 . (2)已知亚硒酸是弱酸.试写出向亚硒酸溶液中通入SO2的离子反应方程式: . 22H.盐酸.硫酸和硝酸是中学阶段所常见的“三大酸 .现请就三大酸与金属铜反应情况.填空回答下列问题: (1)我们知道.稀盐酸不与Cu反应.在稀盐酸中加入H2O2后.则可使铜顺利溶解.该反应的化学方程式为 . (2)在一定体积的18mol/L的浓硫酸中加入过量铜片.加热使之反应.被还原的硫酸为0.9mol.则浓硫酸的实际体积 (填写“大于 .“等于 .或“小于 )lOOmL. 若使剩余的铜片继续溶解.可在其中加入硝酸盐溶液(如KNO3溶液).则该反应的离子方程式为 . (3)分别将等质量的铜片与等体积均过量的浓硝酸.稀硝酸反应.所得到的溶液前者呈绿色.后者呈蓝色.某同学提出这可能是Cu2+浓度差异引起的.你同意这种看法吗? .原因是 .另一同学提出溶液呈“绿色 是溶液中Cu2+与NO2共存的结果.请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论) . 22R.在硫酸工业生产中.我国采用黄铁矿为原料生产SO2.反应的化学方程式为: .该反应在 中进行. (2)为了有利于SO2的转化为SO3.且能充分利用热能.采用了多层催化剂间有热交换器的接触室.按此密闭体系中气体的流向.则C处流出的气体为 .A.B.C三处气体的温度由高到低的顺序为 . (3)在吸收塔中用 吸收SO3.从吸收塔上部导出的气体再次通入 .进行第二次氧化.再进行一次吸收后将尾气中很少的SO2净化回收.以防污染大气.
网址:http://m.1010jiajiao.com/timu3_id_152167[举报]
硒是一种保健元素,含有硒元素的保健品现已进入市场,已知硒为第四周期第VIA族元素,推测硒元素不可能具有的性质是
[ ]
A.其单质在通常状况下是固体
B.SeO3对应的水化物是一种酸
C.H2Se比HBr稳定
D.常见化合价有-2、+4、+6价
查看习题详情和答案>>
B.SeO3对应的水化物是一种酸
C.H2Se比HBr稳定
D.常见化合价有-2、+4、+6价
U、V、W、X、Y、Z为周期表中1~20号元素,且原子序数逐渐增大.其中只有Z为金属元素,且其最外层和最内层的电子数相等;W是地壳中含量最多的元素;U与X、W与Y为同族元素.请根据上述信息回答:
(1)UW2的电子式是 ,XW2的晶体类型是 ,V的最简氢化物分子的空间构型是 .
(2)VW2在一定条件下可以与V的最简氢化物反应,生成V的单质和水,其化学方程式是 .
(3)YW2是一种大气污染物,工业上可让它与ZW、W2共热反应而消除污染,其产物的化学式为 .
(4)Z与W除可形成化合物ZW外,还可形成化合物ZW2,请写出ZW2与UW2反应的化学方程式 .
查看习题详情和答案>>
(1)UW2的电子式是
(2)VW2在一定条件下可以与V的最简氢化物反应,生成V的单质和水,其化学方程式是
(3)YW2是一种大气污染物,工业上可让它与ZW、W2共热反应而消除污染,其产物的化学式为
(4)Z与W除可形成化合物ZW外,还可形成化合物ZW2,请写出ZW2与UW2反应的化学方程式
(2010?朝阳区一模)已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物.

回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是
(2)①甲的化学式是
②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是
 .
.
(3)Y单质可用来制造Y-空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极.
①若以溶液C为电解质溶液时,正极的反应式为
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
查看习题详情和答案>>

回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
.
| ||
(2)①甲的化学式是
AlCl3
AlCl3
,乙的化学式可能是Na2S或Na2O
Na2S或Na2O
(写一种即可).②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是
Al3++3OH-=Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
Al3++3OH-=Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
.若W2和Z-具有相同电子层结构,则乙的电子式是

(3)Y单质可用来制造Y-空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极.
①若以溶液C为电解质溶液时,正极的反应式为
O2+2H2+4e-=4OH-
O2+2H2+4e-=4OH-
.②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
4Al+3O2+4KOH=4KalO2+2H2O
4Al+3O2+4KOH=4KalO2+2H2O
.(2010?泰安二模)已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,甲、乙、丙均是由上述四种离子中的两种组成的化合物.甲、乙、丙溶于水所得溶液分别呈酸性、碱性和中性.
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解丙的溶液的方法制备该单质,制备反应的化学方程式是
(2)甲的化学式是
(3)Y单质可用来制造Y-空气燃料电池,该电池通常以氢氧化钾溶液为电解质溶液,则正极反应式为
查看习题详情和答案>>
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解丙的溶液的方法制备该单质,制备反应的化学方程式是
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
;
| ||
(2)甲的化学式是
AlCl3
AlCl3
,乙的化学式可能是Na2S或Na2O
Na2S或Na2O
;若将甲的溶液与乙的溶液混合产生沉淀和气体,则反应的离子方程式是2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑
2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑
;(3)Y单质可用来制造Y-空气燃料电池,该电池通常以氢氧化钾溶液为电解质溶液,则正极反应式为
O2+2H2O+4e-→4OH-
O2+2H2O+4e-→4OH-
.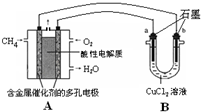 (2013?焦作一模)开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.
(2013?焦作一模)开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是
CO、CH3OH
CO、CH3OH
.乙是一种清洁燃料,工业上可用甲和氢气反应制得.
①T1温度时,在体积为2L的密闭容器中充入2mol甲和6mol H2,反应达到平衡后,测得c(甲)=0.2mol/L,则乙在平衡混合物中的物质的量分数是
| 1 |
| 3 |
| 1 |
| 3 |
②升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是
C
C
(填字母).A.加入2mol甲 B.充入氮气 C.分离出乙 D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的
0.7
0.7
倍(计算结果保留1位小数).(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是
CH4-8e-+2H2O=CO2+8H+
CH4-8e-+2H2O=CO2+8H+
.②当线路中有0.1mol电子通过时,
b
b
(填“a”或“b”)极增重0.32
0.32
g.