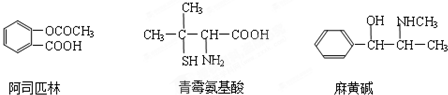
题目内容
(2010?朝阳区一模)已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物.
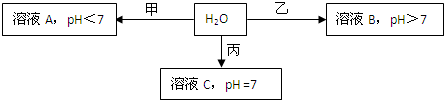
回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是
(2)①甲的化学式是
②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是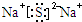
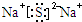 .
.
(3)Y单质可用来制造Y-空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极.
①若以溶液C为电解质溶液时,正极的反应式为
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为

回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
.
| ||
(2)①甲的化学式是
AlCl3
AlCl3
,乙的化学式可能是Na2S或Na2O
Na2S或Na2O
(写一种即可).②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是
Al3++3OH-=Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
Al3++3OH-=Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
.若W2和Z-具有相同电子层结构,则乙的电子式是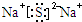
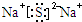
(3)Y单质可用来制造Y-空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极.
①若以溶液C为电解质溶液时,正极的反应式为
O2+2H2+4e-=4OH-
O2+2H2+4e-=4OH-
.②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
4Al+3O2+4KOH=4KalO2+2H2O
4Al+3O2+4KOH=4KalO2+2H2O
.分析:X+、Y3+、Z-、W2-分别是短周期元素X、Y、Z、W形成的离子,Z的单质是一种黄绿色气体,则Z为Cl,则X为Na,由W2-可知,W为O或S,由Y3+可知,Y应为Al,结合图中转化可知,溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,溶液C的pH=7,则丙为NaCl,;
(1)通常状况下,Z的单质是一种黄绿色气体可判断出Z为Cl2;
(2)能与水反应反应后溶液的pH<7,且满足X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子不难推出,甲为AlCl3;同样满足上述条件反应后溶液的pH>7的盐为Na2S或Na2O.
(1)通常状况下,Z的单质是一种黄绿色气体可判断出Z为Cl2;
(2)能与水反应反应后溶液的pH<7,且满足X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子不难推出,甲为AlCl3;同样满足上述条件反应后溶液的pH>7的盐为Na2S或Na2O.
解答:解:通常状况下,Z的单质是一种黄绿色气体可判断出Z为Cl2;能与水反应反应后溶液的pH<7,且满足X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子不难推出,甲为AlCl3;同样满足上述条件反应后溶液的pH>7的盐为Na2S或Na2O.
(1)工业上常用电解溶液C的方法制备该单质,C为NaCl,制备反应的化学方程式是2NaCl+2H2O
H2↑+Cl2↑+2NaOH;
故答案为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH;
(2)①溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,故答案为:AlCl3;Na2S或Na2O;
②若将溶液A与溶液B混合,A为AlCl3,B为Na2S或Na2O,混合反应产生白色沉淀,若B为氧化钠溶于水生成氢氧化钠,反应的离子方程式为:Al3++3OH-=Al(OH)3↓;若B为Na2S溶于水,铝离子和硫离子水解促进反应的离子方程式为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;若W2和Z-具有相同电子层结构,判断W为S元素,则乙为Na2S,电子式为: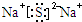 ;
;
故答案为:Al3++3OH-=Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;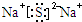 ;
;
(3)Y单质为Al,可用来制造Y-空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极,氧气得到电子生成氢氧根离子,正极电极反应为:
O2+2H2+4e-=4OH-;负极是Al失电子发生氧化反应,电极反应为Al-3e-+4OH-=AlO2-+2H2O;
①正极电极反应是氧气得到电子发生的还原反应,电极反应为:O2+2H2+4e-=4OH-;
故答案为:O2+2H2+4e-=4OH-;
②正极电极反应为:O2+2H2+4e-=4OH-;负极是Al失电子发生氧化反应,电极反应为Al-3e-+4OH-=AlO2-+2H2O;依据电子守恒嘉禾得到反应的化学方程式为:
4Al+3O2+4KOH=4KalO2+2H2O;
故答案为:4Al+3O2+4KOH=4KalO2+2H2O;
(1)工业上常用电解溶液C的方法制备该单质,C为NaCl,制备反应的化学方程式是2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
(2)①溶液A的pH<7,溶液B的pH>7,则甲为AlCl3,乙为Na2S或Na2O,故答案为:AlCl3;Na2S或Na2O;
②若将溶液A与溶液B混合,A为AlCl3,B为Na2S或Na2O,混合反应产生白色沉淀,若B为氧化钠溶于水生成氢氧化钠,反应的离子方程式为:Al3++3OH-=Al(OH)3↓;若B为Na2S溶于水,铝离子和硫离子水解促进反应的离子方程式为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;若W2和Z-具有相同电子层结构,判断W为S元素,则乙为Na2S,电子式为:
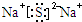 ;
;故答案为:Al3++3OH-=Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;
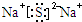 ;
;(3)Y单质为Al,可用来制造Y-空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极,氧气得到电子生成氢氧根离子,正极电极反应为:
O2+2H2+4e-=4OH-;负极是Al失电子发生氧化反应,电极反应为Al-3e-+4OH-=AlO2-+2H2O;
①正极电极反应是氧气得到电子发生的还原反应,电极反应为:O2+2H2+4e-=4OH-;
故答案为:O2+2H2+4e-=4OH-;
②正极电极反应为:O2+2H2+4e-=4OH-;负极是Al失电子发生氧化反应,电极反应为Al-3e-+4OH-=AlO2-+2H2O;依据电子守恒嘉禾得到反应的化学方程式为:
4Al+3O2+4KOH=4KalO2+2H2O;
故答案为:4Al+3O2+4KOH=4KalO2+2H2O;
点评:本题考查物质转化关系的分析判断,物质性质的应用,原子结构的分析判断是解题关键,盐类水解应用.原电池电极反应书写,离子性质的分析判断是解题关键,题目难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目