题目内容
U、V、W、X、Y、Z为周期表中1~20号元素,且原子序数逐渐增大.其中只有Z为金属元素,且其最外层和最内层的电子数相等;W是地壳中含量最多的元素;U与X、W与Y为同族元素.请根据上述信息回答:
(1)UW2的电子式是 ,XW2的晶体类型是 ,V的最简氢化物分子的空间构型是 .
(2)VW2在一定条件下可以与V的最简氢化物反应,生成V的单质和水,其化学方程式是 .
(3)YW2是一种大气污染物,工业上可让它与ZW、W2共热反应而消除污染,其产物的化学式为 .
(4)Z与W除可形成化合物ZW外,还可形成化合物ZW2,请写出ZW2与UW2反应的化学方程式 .
(1)UW2的电子式是
(2)VW2在一定条件下可以与V的最简氢化物反应,生成V的单质和水,其化学方程式是
(3)YW2是一种大气污染物,工业上可让它与ZW、W2共热反应而消除污染,其产物的化学式为
(4)Z与W除可形成化合物ZW外,还可形成化合物ZW2,请写出ZW2与UW2反应的化学方程式
分析:U、V、W、X、Y、Z为周期表中1~20号元素,且原子序数逐渐增大.W是地壳中含量最多的元素,则W为氧元素;W与Y为同族元素,则Y为硫元素;只有Z为金属元素,且其最外层和最内层的电子数相等,其原子序数大于硫元素,则Z处于第四周期,为Ca元素;U与X为同主族元素,都是非金属性,分别为二、三周期元素,至少处于ⅣA或之后的主族,U的原子序数与氧元素至少相差2,则U为碳元素、X为Si元素;V的原子序数介于碳元素与氧元素之间,则V为为氮元素,据此解答.
解答:解:U、V、W、X、Y、Z为周期表中1~20号元素,且原子序数逐渐增大.W是地壳中含量最多的元素,则W为氧元素;W与Y为同族元素,则Y为硫元素;只有Z为金属元素,且其最外层和最内层的电子数相等,其原子序数大于硫元素,则Z处于第四周期,为Ca元素;U与X为同主族元素,都是非金属性,分别为二、三周期元素,至少处于ⅣA或之后的主族,U的原子序数与氧元素至少相差2,则U为碳元素、X为Si元素;V的原子序数介于碳元素与氧元素之间,则V为为氮元素,
(1)UW2为CO2,其电子式为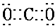 ,XW2为SiO2,属于原子晶体,V的最简氢化物为NH3,分子的空间构型是三角锥型,
,XW2为SiO2,属于原子晶体,V的最简氢化物为NH3,分子的空间构型是三角锥型,
故答案为: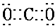 ;原子晶体;三角锥型;
;原子晶体;三角锥型;
(2)NO2在一定条件下可以与NH3反应,生氮气和水,其化学方程式是:6NO2+8NH3=7N2+12H2O,
故答案为:6NO2+8NH3=7N2+12H2O;
(3)SO2是一种大气污染物,工业上可让它与CaO、O2共热反应而消除污染,反应产物为CaSO4,
故答案为:CaSO4;
(4)CaO2与CO2反应类似过氧化钠与二氧化碳反应,其反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2,
故答案为:2CaO2+2CO2=2CaCO3+O2.
(1)UW2为CO2,其电子式为
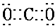 ,XW2为SiO2,属于原子晶体,V的最简氢化物为NH3,分子的空间构型是三角锥型,
,XW2为SiO2,属于原子晶体,V的最简氢化物为NH3,分子的空间构型是三角锥型,故答案为:
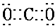 ;原子晶体;三角锥型;
;原子晶体;三角锥型;(2)NO2在一定条件下可以与NH3反应,生氮气和水,其化学方程式是:6NO2+8NH3=7N2+12H2O,
故答案为:6NO2+8NH3=7N2+12H2O;
(3)SO2是一种大气污染物,工业上可让它与CaO、O2共热反应而消除污染,反应产物为CaSO4,
故答案为:CaSO4;
(4)CaO2与CO2反应类似过氧化钠与二氧化碳反应,其反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2,
故答案为:2CaO2+2CO2=2CaCO3+O2.
点评:本题考查结构性质位置关系应用,推断元素是关键,充分利用只有Z是金属结合同族元素推断,对学生的逻辑推理有一定的要求,难度中等.

练习册系列答案
相关题目



 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表: