网址:http://m.1010jiajiao.com/timu3_id_151909[举报]

请回答下列问题:
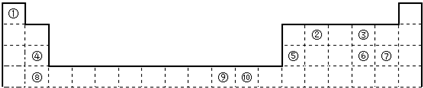
(1)图1中属于d区的元素是
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为


(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
请回答下列问题:
(1)表中属于S区的元素是
(2)写由上述元素组成的分子中电子总数为10,其VSEPR模型与分子立体构型不一致的分子的分子式:
(3)元素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,常把该物质作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.属于含有极性键的极性分子
B.含有4个sp-s的σ键和1个p-p的π键
C.该分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的分子的电子式为
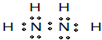
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电子能I(Ev) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号);
(2)表中编号原子中,半径最小的是 (填元素符号,下同),第一电离能最小的是: ,电负性最大的是 ;
电负性大小:⑤元素 ④元素(填大于、等于或小于),第一电离能大小:⑤元素 ④元素( 填大于、等于或小于)。
(3)某元素的价电子排布式为nsn-1npn+1,该元素原子的最外电子层的孤对电子数为 ;该元素还可与元素①形成18电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,反应的离子方程式为: ;
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据:

表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
下表为长式周期表的一部分,其中的编号代表对应的元素。


请回答下列问题:
(1)表中属于d区的元素是 (填编号);
(2)表中编号原子中,半径最小的是 (填元素符号,下同),第一电离能最小的是: ,电负性最大的是 ;
电负性大小:⑤元素 ④元素(填大于、等于或小于),第一电离能大小:⑤元素 ④元素( 填大于、等于或小于)。
(3)某元素的价电子排布式为nsn-1npn+1,该元素原子的最外电子层的孤对电子数为 ;该元素还可与元素①形成18电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,反应的离子方程式为: ;
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据:


表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
查看习题详情和答案>>
(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。

(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(3)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为 ;该元素还可与元素①形成10电子的气体分子Y ,将过量的Y气体通入盛有硝酸银水溶液的试管里,发生化学反应所对应的离子方程式为
。
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
|
电离能I(eV) |
A |
B |
C |
D |
E |
F |
|
I1[来源:学&科&网] |
11.3 |
14.5 |
13.6 |
5.2 |
7.6 |
6.0 |
|
I2 |
24.4 |
29.6 |
35.1 |
49.3 |
15.0 |
18.8 |
|
I3 |
47.9 |
47.4 |
54.9 |
71.6 |
80.1 |
28.4 |
|
I4 |
64.5 |
77.5 |
77.4 |
98.9 |
109.2 |
112.0 |
|
I5 |
392.1 |
97.9 |
113.9 |
138.3 |
141.3 |
153.7 |
请回答:表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是 。
查看习题详情和答案>>
