摘要:0 mol /L×0.2L nFeCl2 nH2 nFeCl2 == 0.3 mol nH2 == 0.3 mol VH2 == nH2×Vm == 0.3 mol×22.4 L/mol == 6.72 L 答:盐酸的物质的量浓度为3.0 mol/L ,生成H2 的体积是6.72 L. 生成FeCl2的物质的量为0.3 mol .
网址:http://m.1010jiajiao.com/timu3_id_151155[举报]
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
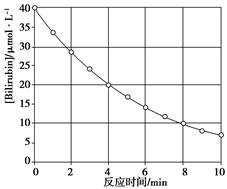
- A.2.5μmol·L-1·min-1和2.0μmol·L-1
- B.2.5μmol·L-1·min-1和2.5μmol·L-1
- C.3.0μmol·L-1·min-1和3.0μmol·L-1
- D.5.0μmol·L-1·min-1和3.0μmol·L-1
AlCl3溶液中Cl-的物质的量浓度为6 moL/L,则AlCl3溶液的物质的量浓度为
- A.1.0 mol·L-1
- B.2 mol·L-1
- C.3 mol·L-1
- D.18 mol·L-1
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g),△H>0.起始N2O5(g)的浓度为5mol/L,其他物质的浓度为零.T1温度下的部分实验数据见表.
实验数据:
下列说法中,正确的是( )
实验数据:
| t/s | 0 | 100 | 300 | 500 |
| c(NO2)/mol/L | 0 | 2.96 | 5.00 | 5.00 |
| A、在恒温恒容条件下,单位时间内生成2n mol N2O5(g),同时消耗4n mol NO2(g),说明该反应达到了平衡状态 |
| B、T1温度下的平衡常数为K1,若维持T1温度不变,增加体系压强,平衡向逆向移动,达到新平衡时,平衡常数为K2,则K1>K2 |
| C、T1温度下的平衡常数为K1=125,500s时反应物转化率为50% |
| D、其他条件不变时,T2温度下反应达到平衡时测得N2O5(g)浓度为2.98mol/L,则T1<T2 |