摘要:10.符合H+ +OH-==H2O这一离子方程式的是 ( ) A.氢氧化钡和硫酸 B.氢氧化钡和盐酸 C.氢氧化铜与盐酸 D.烧碱溶液与醋酸
网址:http://m.1010jiajiao.com/timu3_id_150868[举报]
 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.(1)氨和铵盐在粮食的增产中发挥着极其重要的作用,同时又是重要的工业原料.
①写出实验室制取氨气的化学方程式:
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
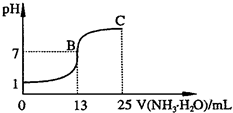
;②常温下,向25mL 0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1NH3?H2O溶液,曲线如图所示(体积变化忽略不计).由图确定HA是
强
强
(填“强”或“弱”)酸,HA与NH3?H2O恰好完全反应时,混合溶液中由水电离出的c(H+)>
>
(填“>”、“>”或“=”)0.1mol?L-1HA溶液中由水电离出的c(H+);写出C点时混合溶液中各离子浓度由大到小的顺序为c(NH4+)>c(A-)>c(OH-)>c(H+)
c(NH4+)>c(A-)>c(OH-)>c(H+)
;(2)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是氮化物A.粉末状A能够与水反应,所得产物中有一种酸性氧化物,它是工业上生产玻璃的主要原料,另一种产物是氨气.请写出A与水反应的化学方程式
Si3N4+6H2O=3SiO2+4NH3↑
Si3N4+6H2O=3SiO2+4NH3↑
;(3)硝酸是医药、军事、化工等领域的重要原料.在实验室中,将适量铁铜混合粉末与稀硝酸充分反应后得到溶液X.若有固体剩余,实验测得溶液X中大量存在的阳离子只有两种,则阳离子为
Fe2+、Cu2+
Fe2+、Cu2+
(写离子符号);若反应后无固体剩余,某同学认为X中除Fe3+、Cu2+外还可能含有Fe2+,若要确认其中的Fe2+,应选用c
c
(选填序号).a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KmnO4溶液 d.浓氨水.
复分解反应存在这样一个规律:较强酸可制取较弱酸.中和反应、盐类的水解也是复分解反应,盐类的水解反应的逆反应是中和反应.盐类的水解反应中,弱酸强碱盐中弱酸根离子对应的弱酸越弱,其盐越容易发生水解.
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)请根据上述信息判断下列反应不能发生的是
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa-→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)一些复分解反应的发生还遵循其他的规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为
(3)物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是
①C6H5OH(苯酚) ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(4)一定温度下,向等体积纯水中分别加入等物质的量的下列物质:①NaOH、②CH3COOH、③NaClO,则水的电离程度最大的是
(5)25℃时,M酸溶液的pH=a,N碱溶液的pH=b.
①若X为强酸,Y为强碱,且a+b=14,若两者等体积混合后,溶液的pH=
②若X的化学式为HR,Y的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性,则混合溶液中必定有一种离子能发生水解,该离子为
a c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
b c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
c c(R-)>c(M+)>c(H+)>c(OH-)
d c(M+)>c(R-)>c(OH-)>c(H+)
e c(M+)+c(H+)=c(R-)+c(OH-)
查看习题详情和答案>>
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
AD
AD
(填编号).A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa-→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)一些复分解反应的发生还遵循其他的规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为
反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
.(3)物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是
①④②③⑤
①④②③⑤
(填编号).①C6H5OH(苯酚) ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(4)一定温度下,向等体积纯水中分别加入等物质的量的下列物质:①NaOH、②CH3COOH、③NaClO,则水的电离程度最大的是
③
③
(填编号).(5)25℃时,M酸溶液的pH=a,N碱溶液的pH=b.
①若X为强酸,Y为强碱,且a+b=14,若两者等体积混合后,溶液的pH=
7
7
,此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是酸为二元强酸,碱为一元强碱
酸为二元强酸,碱为一元强碱
.②若X的化学式为HR,Y的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性,则混合溶液中必定有一种离子能发生水解,该离子为
R-
R-
(填离子符号);混合后的溶液中,下列微粒浓度大小关系正确的是c e
c e
(填序号).a c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
b c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
c c(R-)>c(M+)>c(H+)>c(OH-)
d c(M+)>c(R-)>c(OH-)>c(H+)
e c(M+)+c(H+)=c(R-)+c(OH-)
下列为元素周期表中的一部分,按要求回答下列问题.
(1)这些元素中最不活泼的元素名称为:
(2)元素⑥⑦⑩的最高价氧化物对应的水化物中碱性最强的是(填化学式):
(3)元素⑨的单质与H2O反应的离子方程式为:
(4)元素③的氧化物与氢氧化钾溶液反应的离子方程式为
(5)元素①④⑩形成的化合物中的化学键类型为:
(6)比较元素⑥⑦⑧⑨离子的半径由大到小的顺序(填化学符号)为:
(7)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的
查看习题详情和答案>>
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ④ | ⑤ | |||||
| 3 | ⑥ | ⑦ | ③ | ⑧ | ⑨ | |||
| 4 | ⑩ | |||||||
氖
氖
;(2)元素⑥⑦⑩的最高价氧化物对应的水化物中碱性最强的是(填化学式):
KOH
KOH
;(3)元素⑨的单质与H2O反应的离子方程式为:
Cl2+H2O═H++Cl-+HClO
Cl2+H2O═H++Cl-+HClO
;(4)元素③的氧化物与氢氧化钾溶液反应的离子方程式为
Al2O3+2OH-+3H2O=2[Al(OH)4]-
Al2O3+2OH-+3H2O=2[Al(OH)4]-
;(5)元素①④⑩形成的化合物中的化学键类型为:
离子键,共价键
离子键,共价键
.(6)比较元素⑥⑦⑧⑨离子的半径由大到小的顺序(填化学符号)为:
S2->Cl->Na+>Mg2+
S2->Cl->Na+>Mg2+
.(7)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的
周期性变化
周期性变化
,请写出主族元素在元素周期表中的位置与元素原子结构的关系:元素的周期数即为原子核外电子层数,元素的主族序数即为元素原子的最外层电子数
元素的周期数即为原子核外电子层数,元素的主族序数即为元素原子的最外层电子数
.(14分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
|
a |
|
b |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
d |
|
|
|
|
e |
f |
g |
h |
|
|
i |
|
||||||||||
|
|
|
|
|
|
|
|
|
j |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)j是钴元素,试画出该元素的原子结构示意图 。
(2)c、d原子半径大小c d,第一电离能大小关系是c d,电负性大小关系是c d。(以上填“>”” “<”)
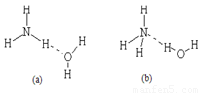
(3)已知NH3·H2O的电离方程式为NH3·H2O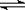 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____
__ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____
__ (填序号) 。
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(KJ·mol-):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
表中X、Y可能分别为以上元素中的 、 (填写元素符号)元素。
查看习题详情和答案>>
 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
[Ar]3d74s2
[Ar]3d74s2
.(2)c、d原子半径大小c
>
>
d,第一电离能大小关系是c>
>
d,电负性大小关系是c<
<
d.(以上填“>”或“<”)(3)已知NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
(b)
(b)
(填序号,见图).(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ?mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
Mg
Mg
、Al
Al
(填写元素符号).