题目内容
 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.(1)氨和铵盐在粮食的增产中发挥着极其重要的作用,同时又是重要的工业原料.
①写出实验室制取氨气的化学方程式:
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
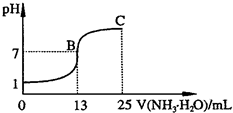
;②常温下,向25mL 0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1NH3?H2O溶液,曲线如图所示(体积变化忽略不计).由图确定HA是
强
强
(填“强”或“弱”)酸,HA与NH3?H2O恰好完全反应时,混合溶液中由水电离出的c(H+)>
>
(填“>”、“>”或“=”)0.1mol?L-1HA溶液中由水电离出的c(H+);写出C点时混合溶液中各离子浓度由大到小的顺序为c(NH4+)>c(A-)>c(OH-)>c(H+)
c(NH4+)>c(A-)>c(OH-)>c(H+)
;(2)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是氮化物A.粉末状A能够与水反应,所得产物中有一种酸性氧化物,它是工业上生产玻璃的主要原料,另一种产物是氨气.请写出A与水反应的化学方程式
Si3N4+6H2O=3SiO2+4NH3↑
Si3N4+6H2O=3SiO2+4NH3↑
;(3)硝酸是医药、军事、化工等领域的重要原料.在实验室中,将适量铁铜混合粉末与稀硝酸充分反应后得到溶液X.若有固体剩余,实验测得溶液X中大量存在的阳离子只有两种,则阳离子为
Fe2+、Cu2+
Fe2+、Cu2+
(写离子符号);若反应后无固体剩余,某同学认为X中除Fe3+、Cu2+外还可能含有Fe2+,若要确认其中的Fe2+,应选用c
c
(选填序号).a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KmnO4溶液 d.浓氨水.
分析:(1)根据实验室制取氨气的化学反应原理书写化学方程式;根据酸碱中和反应和盐类水解的知识解答.
(2)根据产物和质量守恒定律分析出A中含有的元素,继而书写并配平化学方程式.
(3)根据离子反应思考.
(2)根据产物和质量守恒定律分析出A中含有的元素,继而书写并配平化学方程式.
(3)根据离子反应思考.
解答:解;(1)①实验室用氯化铵和碱石灰制取氨气,其化学方程式是:2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O;
②根据HA+NH3?H2O=NH4A+H2O可知,与25mL 0.1mol?L-1HA完全反应需要0.2mol?L-1NH3?H2O溶液12.5mL,而图示显示,加入0.2mol?L-1NH3?H2O溶液13mL时才呈中性,说明恰好反应时溶液呈酸性,即NH4A溶液呈酸性,所以HA是强酸.
NH4A溶液呈酸性,是因为铵根离子水解,促进了水的电离平衡,而HA是强酸,电离出的氢离子抑制了水的电离平衡,即混合溶液中由水电离出的c(H+)大于0.1mol?L-1HA溶液中由水电离出的c(H+).
图中C点代表25mL 0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1NH3?H2O溶液25mL,根据HA+NH3?H2O=NH4A+H2O可知,氨水过量12.5mL,即所得溶液中为NH4A和NH3?H2O的混合液,且二者的浓度均为0.05mol/L.该混合液中存在铵根离子的水解平衡和NH3?H2O的电离平衡,而且NH3?H2O的电离程度远大于铵根离子的水解程度,即溶液显碱性,其中的离子浓度大小关系为:c(NH4+)>c(A-)>c(OH-)>c(H+),
故答案为:强;>;c(NH4+)>c(A-)>c(OH-)>c(H+);
(2)生产玻璃的主要原料为二氧化硅、大理石、碳酸钠,其中是酸性氧化物的只有二氧化硅,即粉末A与水反应生成二氧化硅和氨气,则A中必含硅元素和氮元素,因此A是Si3N4,它与水反应的化学方程式是:Si3N4+6H2O=3SiO2+4NH3↑,故答案为:Si3N4+6H2O=3SiO2+4NH3↑;
(3)铁铜混合粉末与稀硝酸充分反应,若有固体剩余,无论剩余铁或是剩余铜,都不会存在Fe3+和H+,因为含有两种阳离子,所以这两种阳离子只能是Fe2+、Cu2+.
因为溶液中有Fe3+、Cu2+,因此要检验Fe2+,不能使用把Fe2+氧化为Fe3+再去检验Fe3+的方法,a、b、d均不正确.因为Fe2+具有还原性,酸性KmnO4溶液具有氧化性,因此可以向酸性KmnO4溶液中加入混合液,观察酸性KmnO4溶液是否褪色,若褪色,说明含有Fe2+,若不退色,说明不含有Fe2+,故应选c.
故答案为:Fe2+、Cu2+;c.
故答案为:2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O;
②根据HA+NH3?H2O=NH4A+H2O可知,与25mL 0.1mol?L-1HA完全反应需要0.2mol?L-1NH3?H2O溶液12.5mL,而图示显示,加入0.2mol?L-1NH3?H2O溶液13mL时才呈中性,说明恰好反应时溶液呈酸性,即NH4A溶液呈酸性,所以HA是强酸.
NH4A溶液呈酸性,是因为铵根离子水解,促进了水的电离平衡,而HA是强酸,电离出的氢离子抑制了水的电离平衡,即混合溶液中由水电离出的c(H+)大于0.1mol?L-1HA溶液中由水电离出的c(H+).
图中C点代表25mL 0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1NH3?H2O溶液25mL,根据HA+NH3?H2O=NH4A+H2O可知,氨水过量12.5mL,即所得溶液中为NH4A和NH3?H2O的混合液,且二者的浓度均为0.05mol/L.该混合液中存在铵根离子的水解平衡和NH3?H2O的电离平衡,而且NH3?H2O的电离程度远大于铵根离子的水解程度,即溶液显碱性,其中的离子浓度大小关系为:c(NH4+)>c(A-)>c(OH-)>c(H+),
故答案为:强;>;c(NH4+)>c(A-)>c(OH-)>c(H+);
(2)生产玻璃的主要原料为二氧化硅、大理石、碳酸钠,其中是酸性氧化物的只有二氧化硅,即粉末A与水反应生成二氧化硅和氨气,则A中必含硅元素和氮元素,因此A是Si3N4,它与水反应的化学方程式是:Si3N4+6H2O=3SiO2+4NH3↑,故答案为:Si3N4+6H2O=3SiO2+4NH3↑;
(3)铁铜混合粉末与稀硝酸充分反应,若有固体剩余,无论剩余铁或是剩余铜,都不会存在Fe3+和H+,因为含有两种阳离子,所以这两种阳离子只能是Fe2+、Cu2+.
因为溶液中有Fe3+、Cu2+,因此要检验Fe2+,不能使用把Fe2+氧化为Fe3+再去检验Fe3+的方法,a、b、d均不正确.因为Fe2+具有还原性,酸性KmnO4溶液具有氧化性,因此可以向酸性KmnO4溶液中加入混合液,观察酸性KmnO4溶液是否褪色,若褪色,说明含有Fe2+,若不退色,说明不含有Fe2+,故应选c.
故答案为:Fe2+、Cu2+;c.
点评:本题是多个知识点的组合题,对知识的覆盖面较大,具有一定的综合性,要求平时学习时要掌握牢固、全面的基础知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目