摘要:23.有机物A.B.C.D.E之间发生如下的转化: 已知A含6个C原子.B.C.D都含2个C原子.A在酒化酶作用下发生的反应中.分子个数关系为:A -→ 2B + 2甲 (1)请写出下列转化的反应方程式 ① (C6H10O5)n →A: . ② A→B: , ③ C→D: . (2)乙二醇( HO-CH2-CH2-OH )与上图中有机物D在浓硫酸和加热条件下反应的化学方 程式为: .反应类型为: 反应. (3)实验室用右图所示的装置制取E.请回答下列问题: ① a试管中浓硫酸的作用是: , ② b试管中饱和Na2CO3溶液的主要作用: . ③ b试管里出现的现象为: .
网址:http://m.1010jiajiao.com/timu3_id_150240[举报]
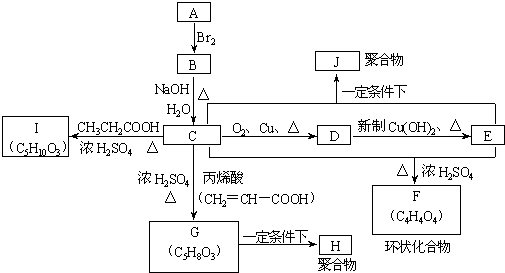
已知有机物 A、B、C、D、E、F之间的转化关系如图所示。D只含一种官能团,常用做汽车发动机的抗冻剂,E为聚合物,F的相对分子质量为26。根据信息回答下列问题。
已知RCH2CH2OH RCH=CH2
RCH=CH2
 RCH=CH2
RCH=CH2 
(1)写出A、F的结构简式:A________________ 、 F_____________________ ;
(2)写出下列反应的化学方程式及反应类型:
B转化为E的反应:_________________________________ ,反应类型_______________
C转化为D的反应:__________________________________ ,反应类型___________________
A+G生成CH3COOC2H5的反应: ________________________,反应类型__________________
查看习题详情和答案>>
(2)写出下列反应的化学方程式及反应类型:
B转化为E的反应:_________________________________ ,反应类型_______________
C转化为D的反应:__________________________________ ,反应类型___________________
A+G生成CH3COOC2H5的反应: ________________________,反应类型__________________
A、B、C、D、E、F、G、H、I、J分别代表十种不同的有机物(其中A是化学工业重要原料之一).它们之间的相互转化关系如图: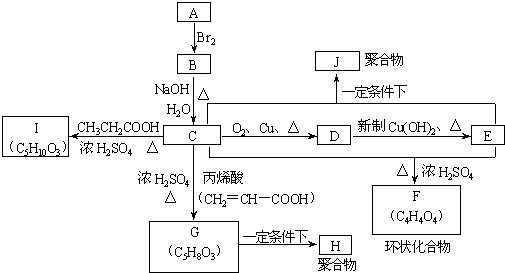
请回答下列问题:
(1)A的结构式简为
 ;指G→H的反应类型
;指G→H的反应类型
(2)写出下列转化的化学方程式.
①C→I
②C+E→J
(3)G有多种同分异构体,其中能与NaOH溶液及硫酸溶液均可反应;能发生银镜反应且生成的银与相应有机物的物质的量比为4:1,由符合条件的同分异构体数目有
查看习题详情和答案>>

请回答下列问题:
(1)A的结构式简为
CH2=CH2
CH2=CH2
;F的结构简式为

加聚反应
加聚反应
.(2)写出下列转化的化学方程式.
①C→I
CH3CH2COOH+HOCH2CH2OH
CH3CH2COOCH2CH2OH+H2O
| 浓硫酸 |
| △ |
CH3CH2COOH+HOCH2CH2OH
CH3CH2COOCH2CH2OH+H2O
| 浓硫酸 |
| △ |
②C+E→J
nCH2OHCH2CH2OH+nHOOCCOOH
 +(2n-1)H2O
+(2n-1)H2O
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2OnCH2OHCH2CH2OH+nHOOCCOOH
 +(2n-1)H2O
+(2n-1)H2O
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2O(3)G有多种同分异构体,其中能与NaOH溶液及硫酸溶液均可反应;能发生银镜反应且生成的银与相应有机物的物质的量比为4:1,由符合条件的同分异构体数目有
5
5
种,写出其中的一种同分异构体结构简式HCOOCH2CH2CH2CHO
HCOOCH2CH2CH2CHO
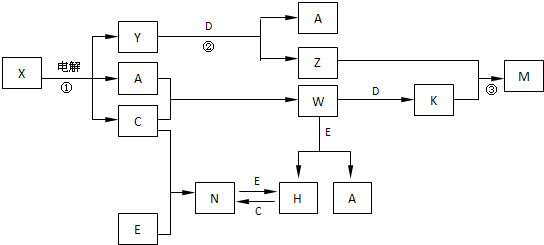
.A、B、C、D、E是中学化学常见单质,构成它们的元素的原子序数分别为a、b、c、d、е;且3(a+b)=2(a+c)=3(d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
(1)Y的电子式为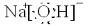
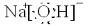 ,构成E单质的元素的原子结构示意图为:
,构成E单质的元素的原子结构示意图为: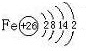
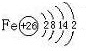 .
.
(2)反应③的离子方程式为
(3)E的氧化物与D在一定条件下反应的化学方程式为:
(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式
(5)用离子方程式表示Z溶液显碱性的原因:
(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为
(7)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
查看习题详情和答案>>

(1)Y的电子式为
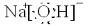
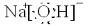
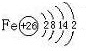
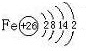
(2)反应③的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)E的氧化物与D在一定条件下反应的化学方程式为:
Fe2O3+2Al
2Fe+Al2O3
| ||
Fe2O3+2Al
2Fe+Al2O3
,在实验室中,引发该反应的实验操作为
| ||
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
.(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
.(5)用离子方程式表示Z溶液显碱性的原因:
AlO2-+2H2O?Al(OH)3+OH-
AlO2-+2H2O?Al(OH)3+OH-
.(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为
分子
分子
晶体.(7)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
1:104
1:104
.