题目内容
A、B、C、D、E是中学化学常见单质,构成它们的元素的原子序数分别为a、b、c、d、е;且3(a+b)=2(a+c)=3(d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):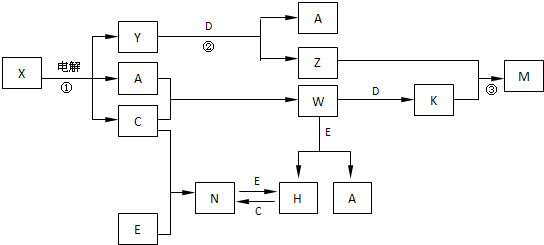
(1)Y的电子式为______,构成E单质的元素的原子结构示意图为:______.
(2)反应③的离子方程式为______.
(3)E的氧化物与D在一定条件下反应的化学方程式为:______,在实验室中,引发该反应的实验操作为______.
(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式______.
(5)用离子方程式表示Z溶液显碱性的原因:______.
(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为______晶体.
(7)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为______.
解:A、B、C、D、E是中学化学常见单质,依据题中的转化关系,X A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;
A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;
综上所述转化关系中的物质分别是:A、H2;B、Na;C、Cl2;D、Al;E、Fe;H、FeCl2;K、AlCl3;M、Al(OH)3;N、FeCl3;W、HCl;X、NaCl;Y、NaOH;Z、NaAlO2;
(1)Y为NaOH,是离子化合物,书写的电子式为: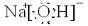 组
组
成E单质的元素是铁,铁的原子结构示意图为: 故答案为:
故答案为: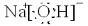
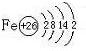
(2)转化关系中反应③是Z(NaAl02)+K(AlCl3)→M(Al(OH)3)的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)E的氧化物与D在一定条件下反应是氧化铁和铝发生的铝热反应,化学方程式为:Fe2O3+2Al 2Fe+Al2O3;在实验室中,引发该反应的实验操作为:将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;故答案为:Fe2O3+2Al
2Fe+Al2O3;在实验室中,引发该反应的实验操作为:将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;故答案为:Fe2O3+2Al 2Fe+Al2O3;将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;
2Fe+Al2O3;将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;
(4)已知常温下,1gA的单质H2与C的单质Cl2在点燃条件下完全反应生成HCl,放出的热量为92.3kJ,1gH2物质的量为0.5mol,放热92.3KJ,1molH2完全反应放热184.6kJ,则HCl分解生成H2和Cl2的反应为吸热反应,热化学方程式为:2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol;故答案为:
(5)Z溶液是NaAl02溶液,偏铝酸根离子水解显碱性,离子方程式为:AlO2-+2H2O?Al(OH)3+OH- 故答案为;AlO2-+2H2O?Al(OH)3+OH-
(6)固体N为FeCl3常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,这是分子晶体的性质,所以判断为FeCl3为分子晶体;
(7)25℃时,PH=5的HCl溶液和FeCl3的水溶液中由H2O电离出来的H+离子浓度之比,依据溶液中存在的离子积常数计算,PH=5的HCl溶液中[H+]酸?[OH-]水=10-14;[H+]水=[OH-]水=10-9mol/L;PH=5的FeCl3的水溶液中存在水解平衡溶液中存在离子积[H+]水?[OH-]剩余=10-14;[H+]水=[OH-]水=10-5;25℃时,PH=5的HCl溶液和FeCl3的水溶液中由H2O电离出来的H+离子浓度之比为10-9:10-5=1:104 故答案为:1:104;
分析:A、B、C、D、E是中学化学常见单质,依据题中的转化关系,X A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;根据判断出的物质和转化关系回答问题;
A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;根据判断出的物质和转化关系回答问题;
点评:本题考查了元素化合物的物质推断,主要考查饱和食盐水的电解产物的分析判断,铝及其化合物、铁及其化合物的性质应用,水解离子方程式、热化学方程式的书写,水溶液中的离子积的应用,综合性较强,难度较大.
 A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;
A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;综上所述转化关系中的物质分别是:A、H2;B、Na;C、Cl2;D、Al;E、Fe;H、FeCl2;K、AlCl3;M、Al(OH)3;N、FeCl3;W、HCl;X、NaCl;Y、NaOH;Z、NaAlO2;
(1)Y为NaOH,是离子化合物,书写的电子式为:
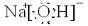 组
组成E单质的元素是铁,铁的原子结构示意图为:
 故答案为:
故答案为: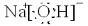
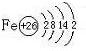
(2)转化关系中反应③是Z(NaAl02)+K(AlCl3)→M(Al(OH)3)的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)E的氧化物与D在一定条件下反应是氧化铁和铝发生的铝热反应,化学方程式为:Fe2O3+2Al
 2Fe+Al2O3;在实验室中,引发该反应的实验操作为:将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;故答案为:Fe2O3+2Al
2Fe+Al2O3;在实验室中,引发该反应的实验操作为:将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;故答案为:Fe2O3+2Al 2Fe+Al2O3;将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;
2Fe+Al2O3;将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;(4)已知常温下,1gA的单质H2与C的单质Cl2在点燃条件下完全反应生成HCl,放出的热量为92.3kJ,1gH2物质的量为0.5mol,放热92.3KJ,1molH2完全反应放热184.6kJ,则HCl分解生成H2和Cl2的反应为吸热反应,热化学方程式为:2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol;故答案为:
(5)Z溶液是NaAl02溶液,偏铝酸根离子水解显碱性,离子方程式为:AlO2-+2H2O?Al(OH)3+OH- 故答案为;AlO2-+2H2O?Al(OH)3+OH-
(6)固体N为FeCl3常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,这是分子晶体的性质,所以判断为FeCl3为分子晶体;
(7)25℃时,PH=5的HCl溶液和FeCl3的水溶液中由H2O电离出来的H+离子浓度之比,依据溶液中存在的离子积常数计算,PH=5的HCl溶液中[H+]酸?[OH-]水=10-14;[H+]水=[OH-]水=10-9mol/L;PH=5的FeCl3的水溶液中存在水解平衡溶液中存在离子积[H+]水?[OH-]剩余=10-14;[H+]水=[OH-]水=10-5;25℃时,PH=5的HCl溶液和FeCl3的水溶液中由H2O电离出来的H+离子浓度之比为10-9:10-5=1:104 故答案为:1:104;
分析:A、B、C、D、E是中学化学常见单质,依据题中的转化关系,X
 A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;根据判断出的物质和转化关系回答问题;
A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;根据判断出的物质和转化关系回答问题;点评:本题考查了元素化合物的物质推断,主要考查饱和食盐水的电解产物的分析判断,铝及其化合物、铁及其化合物的性质应用,水解离子方程式、热化学方程式的书写,水溶液中的离子积的应用,综合性较强,难度较大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
