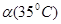摘要:水的电离过程为H2OH++OH-,在不同温度下其平衡常数为K=1.0×10-14,K =2.1×10-14.则下列叙述正确的是 A.C(H+)随着温度升高而降低 B.在35℃时.C(H+)>C(OH-) C.水的电离的程度? D.水的电离是吸热的
网址:http://m.1010jiajiao.com/timu3_id_149636[举报]
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
| A.c(H+)随着温度升高而升高 | B.35℃时,c(H+)>c(OH-) |
C.水的电离度 < <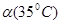 | D.水的电离是吸热的 |
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是
A.C(H+)随着温度升高而降低
B.在35℃时,C(H+)>C(OH-)
C.水的电离度?(25℃)>?(35℃)
D.水的电离是吸热的
查看习题详情和答案>>
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
A.c(H+)随着温度升高而升高 B.35℃时,c(H+)>c(OH-)
C.水的电离度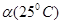 <
<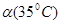 D.水的电离是吸热的
D.水的电离是吸热的
查看习题详情和答案>>
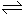 H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14。则下列叙述正确的是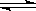 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )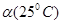 <
<