网址:http://m.1010jiajiao.com/timu3_id_149580[举报]
下列各组溶液中,不用其它化学试剂,面用物质间两两混合的方法不可能鉴别出的是。
A.NaOH、AlCl3、盐酸、Na2CO3 B.BaCl2、AgNO3、Na2CO3、CaCl2
C.淀粉、淀粉和KI、KI、溴水 D.NaHCO3、稀硫酸、Na2SiO3、Na2SO3
查看习题详情和答案>>A.碱式滴定管在装碱液前未用标准液润洗2~3次
B.开始实验时,碱式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.盛盐酸的锥形瓶用盐酸润洗2~3次
D.锥形瓶内溶液颜色变化由无色变为粉红色,立即记下滴定管液面所在刻度
E.滴定前平视,滴定终点时俯视滴定管读数
(2)下图为某一浓度的NaOH溶液滴定10 mL一定浓度的HCl溶液的图示:
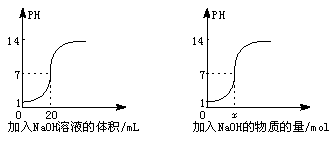
根据上述两图分析:①HCl溶液的浓度是______,NaOH溶液的浓度是______.
②x=______.
(3)现有四瓶溶液,分别是NaCl(0.1 mol/L)、HCl(0.1 mol/L)、NaOH(0.1 mol/L)和酚酞溶液(0.1%)中的一种.若不用其他试剂把它们一一鉴别开来,实验步骤如下:
①各取溶液少许,两两混合,根据现象不同可分成两组:Ⅰ组是HCl和______,Ⅱ组是NaOH和______.
②取Ⅱ组C、D混合液,不断滴入Ⅰ组A、B中的A溶液,无明显现象,则A是______,B是______.
③取已鉴别出的B溶液2 mL,滴入3滴未知C溶液,再加入D溶液4 mL,在这个过程中无明显颜色变化,则C是______,D是______.
查看习题详情和答案>>
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子是![]() ,人体缺乏这种维生素能得坏血症,所以维生素C又被称为抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳品中都富含维生系C,如新鲜橙汁维生素C的含量在500mg/L左右。
,人体缺乏这种维生素能得坏血症,所以维生素C又被称为抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳品中都富含维生系C,如新鲜橙汁维生素C的含量在500mg/L左右。
某校课外活动小组测定了某种品牌的软包装橙汁中维生素C的含量。下面是测定实验分析报告。(请填写有关空白)
(1)测定目的:测定××牌软包装橙汁维生素C含量
(2)测定原理:![]()
(3)实验用品及试剂:
①仪器和用品:(自选,略)
②试剂:指示剂________(填名称)、浓度为7.50×![]() mol/L标准碘溶液、蒸馏水等。
mol/L标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后盛装好标准碘溶液待用。
②打开橙汁包装,目测:颜色--橙黄色,澄清度--好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________,直到滴定终点。滴定到终点的现象是________。
(5)数据记录与处理:(请完成下表中各实验记录项目,不必填数据。)
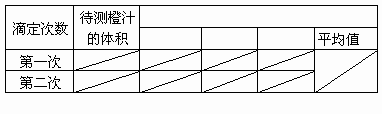
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg/L。
(6)问题讨论:
①滴定时能否剧烈摇动锥形瓶?为什么?________,________。
②从分析数据看,该软包装橙汁是否是纯天然橙汁?________(A.是 B.不是C.不能确定--填编号)。制造商可能采取的做法是________(A.加水稀释天然橙汁 B.橙汁包装浓缩 C.将维生素C作为添加剂)。
(7)请你站在国家质检执法人员的角度作出对××牌软包装橙汁的处理意见(A.继续生产 B.停产整顿 C.调查后再作结论)
查看习题详情和答案>>某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论????????? ???????????????? ? 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 ??? (填字母序号)。
? A.溶液温度下降? B.溶液温度升高??? C.滴入酚酞后呈浅红色? ????? D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象???????????????????? 。


(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体,????????? (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是????????? 。
A.装置I的气球体积较大???????????? B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算?????? D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
实验方案 | 预测现象 | 预测依据 | 实际结果 |
实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1:???????????????? ????? ???????????? ;实验2:???????????????????? ?????? ?????? 。
查看习题详情和答案>>
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象 。

(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是 。
A.装置I的气球体积较大 B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1: ;实验2: 。 查看习题详情和答案>>