摘要:有反应:2C6H5CHO + NaOH → C6H5CH2OH + C6H5COONa.据此. 以下说法正确的是 (A)该反应为氧化还原反应 (B)苯甲醛只还原为苯甲醇 (C)苯甲醛只氧化为苯甲酸 (D)该反应为取代反应
网址:http://m.1010jiajiao.com/timu3_id_149437[举报]
有反应2C 6H5CHO+NaOH C6H5COONa+C6H5CH2OH,对于该反应,以下说法正确的是( )
C6H5COONa+C6H5CH2OH,对于该反应,以下说法正确的是( )
A.该反应为酸碱中和反应而非氧化还原反应 B.该反应中苯甲醛只作还原剂
C.该反应中苯甲醛只作氧化剂 D.该反应中苯甲醛既被氧化又被还原
查看习题详情和答案>>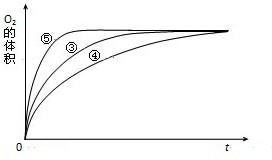 (2011?顺德区模拟)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(2011?顺德区模拟)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
降低了活化能
降低了活化能
.(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为
H2O2?H++HO2-
H2O2?H++HO2-
.(3)实验①和②的目的是
探究浓度对反应速率的影响
探究浓度对反应速率的影响
.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)
向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)
.(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
分析上图能够得出的实验结论是
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是
(2)写出该反应的化学方程式(可以不配平)
(3)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
查看习题详情和答案>>
(1)该反应中的还原剂是
H2O2
H2O2
.(2)写出该反应的化学方程式(可以不配平)
H2CrO4+H2O2→Cr(OH)3+H2O+O2↑
H2CrO4+H2O2→Cr(OH)3+H2O+O2↑
.(3)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
3.36
3.36
L.(2010?长春一模)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中,H2O2只发生如下过程:H2O2-→O2.
(1)该反应的还原剂是
(2)若反应转移了0.3mol电子,则产生的气体在标准状况下的体积是
(3)写出该反应的化学方程式
查看习题详情和答案>>
(1)该反应的还原剂是
H2O2
H2O2
.(2)若反应转移了0.3mol电子,则产生的气体在标准状况下的体积是
3.36
3.36
L.(3)写出该反应的化学方程式
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
.(2013?烟台模拟)硫、氮、碘都是重要的非金属元素.
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=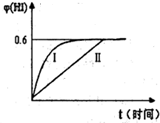
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
查看习题详情和答案>>
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
H2S
H2S
.若反应过程中转移了0.3mol电子,则反应的HNO3的质量是6.3
6.3
g.(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=
-9
-9
kJ?mol-1.
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
0.05
0.05
mol?L-1.②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
AB
AB
(填编号),在这种条件下平衡常数K值不变
不变
(填“增大”、“变小”或“不变’,).A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
37%
37%
.