摘要:根据要求完成下列问题. ⑴写出氯气与消石灰反应制取漂粉精的化学方程式: . ⑵用电子式表示NaCl 的形成过程: . ⑶写出炭和浓硫酸在加热条件下反应的化学方程式: . (4)二氧化硅与炭在高温下反应制硅的化学方程式: .
网址:http://m.1010jiajiao.com/timu3_id_148537[举报]
 根据要求完成下列问题:
根据要求完成下列问题:(1)有以下物质:①SO2Cl2 ②C2H6 ③CS2 ④HClO ⑤H2O2
含有非极性键的非极性分子是
②
②
;以极性键相结合,具有直线型结构的非极性分子是③
③
;以极性键相结合,具有四面体形结构的极性分子是①
①
;以极性键相结合,具有V型结构的极性分子是④
④
;(2)在S8、SiC、NaCl、C2H5OH中,能形成分子晶体的化合物是
C2H5OH
C2H5OH
,含有氢键的晶体的化学式是C2H5OH
C2H5OH
,属于原子晶体的是SiC
SiC
,四种物质形成的晶体熔点由高到低的顺序是SiC
SiC
>NaCl
NaCl
>S8
S8
>C2H5OH
C2H5OH
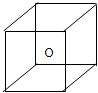
.右图立方体中心的“o”表示SiC晶体中的一个硅原子,请在立方体的顶点用“●”表示出与之紧邻的碳原子.
根据要求完成下列问题:
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是
查看习题详情和答案>>
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、
金属晶体
金属晶体
B、分子晶体
分子晶体
C、原子晶体
原子晶体
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:
Co3+
Co3+
、CN-
CN-
、6
6
.(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是
CO2
CO2
,由非极性键形成的非极性分子是H2
H2
,能形成分子晶体的化合物是H2、CO2、HF
H2、CO2、HF
,含有氢键的晶体的化学式HF
HF
,属于原子晶体的是SiC
SiC
,四种物质熔点由高到低的顺序是SiC、HF、CO2、H2
SiC、HF、CO2、H2
.根据要求完成下列问题
(1)下列不能说明氯的非金属性比硫强的是
①HCl比H2S稳定;
②HClO的氧化性比H2SO4强;
③HClO4酸性比H2SO4强;
④Cl2能与H2S反应生成S;
⑤Cl原子最外层有7个电子,S原子最外层有6个电子;
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS;
⑦氯的电负性大于硫.
(2)下列那些事实说明能说明铝比铁的金属性强
①与盐酸反应,铝的反应速率大;
②铝能与氢氧化钠溶液反应,铁不能;
③在铝\铁\盐酸构成的原电池中,铁片上冒出气泡;
④铁有变价,而铝没有.
(3)①请写出一个能表示碳酸的酸性大于氢氧化铝的离子方程式:
②请写出一个能体现碳酸氢钠与碳酸钠热稳定性强弱的化学方程式:
(4)设计实验证明铜单质的还原性大于亚铁离子.
(5)下列各图示中能较长时间看到Fe(OH)2白色沉淀的是

查看习题详情和答案>>
(1)下列不能说明氯的非金属性比硫强的是
②⑤
②⑤
①HCl比H2S稳定;
②HClO的氧化性比H2SO4强;
③HClO4酸性比H2SO4强;
④Cl2能与H2S反应生成S;
⑤Cl原子最外层有7个电子,S原子最外层有6个电子;
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS;
⑦氯的电负性大于硫.
(2)下列那些事实说明能说明铝比铁的金属性强
①③
①③
.①与盐酸反应,铝的反应速率大;
②铝能与氢氧化钠溶液反应,铁不能;
③在铝\铁\盐酸构成的原电池中,铁片上冒出气泡;
④铁有变价,而铝没有.
(3)①请写出一个能表示碳酸的酸性大于氢氧化铝的离子方程式:
AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
.②请写出一个能体现碳酸氢钠与碳酸钠热稳定性强弱的化学方程式:
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
.
| ||
(4)设计实验证明铜单质的还原性大于亚铁离子.
(5)下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
②③④
②③④
.