题目内容
 根据要求完成下列问题:
根据要求完成下列问题:(1)有以下物质:①SO2Cl2 ②C2H6 ③CS2 ④HClO ⑤H2O2
含有非极性键的非极性分子是
②
②
;以极性键相结合,具有直线型结构的非极性分子是③
③
;以极性键相结合,具有四面体形结构的极性分子是①
①
;以极性键相结合,具有V型结构的极性分子是④
④
;(2)在S8、SiC、NaCl、C2H5OH中,能形成分子晶体的化合物是
C2H5OH
C2H5OH
,含有氢键的晶体的化学式是C2H5OH
C2H5OH
,属于原子晶体的是SiC
SiC
,四种物质形成的晶体熔点由高到低的顺序是SiC
SiC
>NaCl
NaCl
>S8
S8
>C2H5OH
C2H5OH
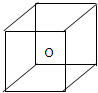
.右图立方体中心的“o”表示SiC晶体中的一个硅原子,请在立方体的顶点用“●”表示出与之紧邻的碳原子.
分析:(1)同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;
(2)分子晶体中粒子之间的作用力为分子间作用力;氢键是某些氢化物(NH3、H2O、HF)分子间存在的比分子间作用力稍强的作用力,它的存在使氢化物的熔点、沸点相对较高;原子晶体中,组成微粒为原子,原子之间以共价键成键;原子晶体的熔沸点大于离子晶体大于分子晶体;根据原子晶体SiC的空间结构来回答;
(2)分子晶体中粒子之间的作用力为分子间作用力;氢键是某些氢化物(NH3、H2O、HF)分子间存在的比分子间作用力稍强的作用力,它的存在使氢化物的熔点、沸点相对较高;原子晶体中,组成微粒为原子,原子之间以共价键成键;原子晶体的熔沸点大于离子晶体大于分子晶体;根据原子晶体SiC的空间结构来回答;
解答:解:(1)①SO2Cl2中含有极性键,结构不对称,正负电荷的中心不重合,属于极性分子,是四面体形结构;
②C2H6中含有极性键和非极性键,但结构对称,正负电荷的中心重合,属于非极性分子;
③CS2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;
④HClO中含有极性键,结构不对称,正负电荷的中心不重合,属于极性分子,具有V型结构;
⑤H2O2中含有极性键和非极性键,但结构不对称,正负电荷的中心不重合,属于极性分子,
故答案为:②;③;①;④;
(2)属于分子晶体的是C2H5OH;C2H5OH中含有氢键;SiC属于原子晶体;原子晶体的熔沸点大于离子晶体大于分子晶体,在分子晶体中,相对分子质量大的熔沸点高;SiC为一种空间网状结构的原子晶体,平均每个正四面体中含有四个最近且等距离的碳原子,故答案为:C2H5OH; C2H5OH; SiC; SiC>NaCl>S8>C2H5OH
 ;
;
②C2H6中含有极性键和非极性键,但结构对称,正负电荷的中心重合,属于非极性分子;
③CS2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;
④HClO中含有极性键,结构不对称,正负电荷的中心不重合,属于极性分子,具有V型结构;
⑤H2O2中含有极性键和非极性键,但结构不对称,正负电荷的中心不重合,属于极性分子,
故答案为:②;③;①;④;
(2)属于分子晶体的是C2H5OH;C2H5OH中含有氢键;SiC属于原子晶体;原子晶体的熔沸点大于离子晶体大于分子晶体,在分子晶体中,相对分子质量大的熔沸点高;SiC为一种空间网状结构的原子晶体,平均每个正四面体中含有四个最近且等距离的碳原子,故答案为:C2H5OH; C2H5OH; SiC; SiC>NaCl>S8>C2H5OH
 ;
;点评:本题是一道结构化学知识题目,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目