摘要: 已知SO2遇H2S气体时表现出氧化性.发生如下反应:SO2+2H2S=3S+2H2O.在标准状况下.向一个容积为1L的容器里加入L的SO2和L的H2S.则反应结束时容器中的压强是开始的 倍.
网址:http://m.1010jiajiao.com/timu3_id_148479[举报]
已知SO2 和H2S两种气体可以发生如下反应:2H2S + SO2 == 3S +2H2O
(1)常温下,向20L真空容器中通人a mol H2S 和 b mol SO2 (a、b都是正整数,且a≤5,b≤5)反应完成后,容器内气体可能达到的最大密度为 g/L
(2)在室温条件下,在一体积不变的的密闭容器中充入H2S和SO2气体,反应前压强为p,反应结束后压强为p/2,则反应前H2S和SO2的体积比是 或 。
查看习题详情和答案>>已知SO2 和H2S两种气体可以发生如下反应:2H2S + SO2 == 3S +2H2O
(1)常温下,向20L真空容器中通人a mol H2S 和 b mol SO2 (a、b都是正整数,且a≤5,b≤5)反应完成后,容器内气体可能达到的最大密度为 g/L
(2)在室温条件下,在一体积不变的的密闭容器中充入H2S和SO2气体,反应前压强为p,反应结束后压强为p/2,则反应前H2S和SO2的体积比是 或 。
查看习题详情和答案>>
已知①实验室制取H2S的原理是:FeS+H2SO4=FeSO4+H2S↑;根据图中A~D的实验装置和试剂进行实验,回答下列问题:
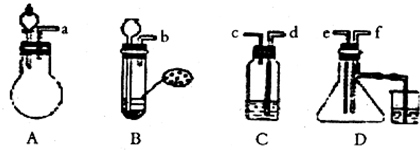
(1)装置A是由双孔塞、玻璃导管及 和 (填仪器名称)组装起来的.
(2)请你组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性.
①按实验装置把各导管口连接起来,正确的顺序是a、 、 、 、f、 ;
②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有还原性;
③D容器内壁出现 现象,说明了SO2具有氧化性;
(3)D旁的烧杯盛放的NaOH溶液的作用是 .
查看习题详情和答案>>

(1)装置A是由双孔塞、玻璃导管及
(2)请你组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性.
①按实验装置把各导管口连接起来,正确的顺序是a、
②C装置中的溶液是
③D容器内壁出现
(3)D旁的烧杯盛放的NaOH溶液的作用是
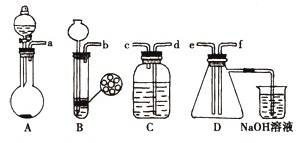 已知实验室制取H2S的实验原理为FeS(块状)+H2SO4═FeSO4+H2S↑.
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4═FeSO4+H2S↑.根据图中A~D的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性.制备SO2的实验原理:
Na2SO3(粉末)+H2SO4(70%)═Na2SO4+SO2↑+H2O.
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是
②C装置中的溶液是
(3)D中产生的现象是
(4)烧杯中发生反应的离子方程式为
(2009?抚顺模拟)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%);
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
(3)选择适宜的催化剂,是否可以提高SO2的转化率?
(4)工业生产硫酸产生的尾气主要含SO2和SO3,会造成
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ?mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量.(写出解题过程)
查看习题详情和答案>>
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
;(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
增大压强对SO2的转化率影响不大,同时增大成本
增大压强对SO2的转化率影响不大,同时增大成本
;(3)选择适宜的催化剂,是否可以提高SO2的转化率?
否
否
(填“是”或“否”),是否可以增大该反应所放出的热量?否
否
(填“是”或“否”);(4)工业生产硫酸产生的尾气主要含SO2和SO3,会造成
酸雨
酸雨
(填环境问题),工业上常用足量的浓氨水来吸收,写出相关的离子方程式2NH3?H2O+SO2=2NH4++SO32-+H2O
2NH3?H2O+SO2=2NH4++SO32-+H2O
2NH3?H2O+SO3=2NH4++SO42-+H2O
2NH3?H2O+SO3=2NH4++SO42-+H2O
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ?mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量.(写出解题过程)